امتحان بجروت في الكيمياء 2023
تعليمات
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان.
الفص ل الأوّل – 40 درجة
الفصل الثاني – 60 درجة
المجموع – 100 درجة - موادّ مساعدة يُسمح استعمالها:
- حاسبة (بما في ذلك الحاسبة البيانيّة).
- ملحق قوانين ومعطيات (مُرفق).
- تعليمات خاصّة:
- في الفصل الأوّل يوجد تسعة أسئلة.
في كلّ واحد من الأسئلة 1- 8 معروضة أربع إجابات، يجب اختيار الإجابة الصحيحة. يجب الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
في السؤال 9 يجب الإجابة عن البنود حسب التعليمات. - في الفصل الثاني يوجد خمسة أسئلة. يجب الإجابة عن ثلاثة منها.
- في الفصل الأوّل يوجد تسعة أسئلة.
يجب الكتابة في دفتر الامتحان فقط. يجب كتابة “مسوّدة” في بداية كلّ صفحة تُستعمَل مسوّدة.
كتابة أيّة مسوّدة على أوراق خارج دفتر الامتحان قد تسبّب إلغاء الامتحان.
الأسئلة في هذا النّموذج ترد بصيغة الجمع، ورغم ذلك يجب على كلّ طالبة وطالب الإجابة عنها بشكل فرديّ.
نتمنّى لكم النّجاح!
الأسئلة
الفصل الأوّل (40 درجة)
أجيبوا عن جميع الأسئلة 1- 8.
إذا أجبتم صحيحًا عن سبعة أسئلة على الأقلّ، ستحصلون على الدرجات ال 20 بأكملها.
قبل أن تجيبوا، اقرأوا جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختاروا الإجابة الصحيحة.
* أَشيروا إلى الإجابة التي اخترتموها في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
* في كلّ سؤال، أشيروا بقلم حبر ﺒِ X في المربّع الذي تحت الحرف (أ–د) الذي يدلّ على الإجابة التي اخترتموها.
* في كلّ سؤال يجب الإشارة ﺒِ X واحد فقط.
* لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■
* يُمنَع المحو بالتيپكس.
* انتبهوا: يُحبَّذ ا امتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلًا بالإشارة إلى الإجابات الصحيحة في نموذج ا امتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- الجدول الذي أمامكم يعرضمعطيات عن تركيبة ثلاثة جسيمات أُشير إليها اعتباطيًّا بالأحرف X, Y, Z.
الجسيم عدد البروتونات عدد النيوترونات تنظُّم الإلكترونات X 18 18 2,8,8 Y 17 18 2,8,8 Z 18 20 2,8,8 ما هو التحديد الصحيح؟
- شحنة النواة في الجسيمين X وَ Y هي متطابقة.
- لا توجد شحنة كهربائيّة لكلّ واحد من الجسيمات X وَ Y وَ Z.
- الجسيمان X وَ Z هما نظيران لنفس العنصر.
- ثلاثة الجسيمات X وَ Y وَ Z هي ذرّات لعناصر مختلفة.
- أمامكم الصِّيَغ الجزيئيّة لأربعة جزيئات: CℓCN , CO2, C2Cℓ2 , CS2.
مبنى كلّ واحد من الجزيئات هو خطّيّ.
أمامكم أربعة أقوال “أ-د”، تتعلّق بالأربطة التساهميّة (الكوڤلنتيّة) في الجزيئات وبقطبيّة الجزيئات.
ما هو القول الصحيح؟- في جميع الجزيئات، جميع الأربطة التساهميّة هي قطبيّة.
- الجزيئان C2Cℓ2 وَ CO2 هما قطبيّان.
- في الجزيئين CS2 ו- CO2 توجد أربطة تساهميّة فرديّة (أحاديّة).
- في الجزيئين CℓCN ו- C2Cℓ2 يوجد ربا ط تساهم ي ثلاثيّ.
- خلطوا في كأس كيماويّة 200 ملل من محلول كلوريد الصوديوم، NaCℓ(aq)، بتركيز 0.4M، مع 200 ملل من محلول كلوريد الألومنيوم، AℓCℓ3(aq)، بتركيز 0.4M.
ما هو التركيز المولاريّ لكلّ واحد من الأيونات في المحلول الذي نتج في نهاية الخلط؟Cℓ¯(aq) Aℓ3+(aq) Na+(aq) أ. 0.8M 0.2M 0.2M ب. 0.8M 0.4M 0.4M ﺠ. 0.4M 0.4M 0.4M د. 0.2M 0.2M 0.2M - النموذجان اللذان أمامكم يمثّلان الصيغتين البنائيّتين لجزيئين أُشير إليهما اعتباطيًّا ﺒِ a وَ b.
 أمامكم أربعة أقوال I-IV.
أمامكم أربعة أقوال I-IV.
I. المجموعة الوظيفيّة في الجزيء a هي كيتون.
II. المجموعة الوظيفيّة في الجزيء b هي أميد.
III. بين الجزيئات a يمكن أن تتكوّن أربطة هيدروجينيّة أيضًا.
iV. بين الجزيئات b يمكن أن تتكوّن أربطة هيدروجينيّة أيضًا.
ما هما القولان الصحيحان؟- I وَ II
- II وَ III
- I وَ IV
- II وَ IV
- الشمعة مصنوعة أساسًا من هيدروكربون صيغته الجزيئيّة هي C25H52 (الكتلة المولاريّة: ).
أمامكم تفاعل الحرق الكامل لبخار الهيدروكربون أثناء اشتعال الشمعة:
C25H52(g) + 38O2(g) → 25CO2(g) + 26H2O(g)
وُجد أنّ كمّيّة الطاقة التي انطلقت في تفاعل حرق 1.76 غرام C25H52(g) تساوي 77.825kJ.
ما هو تغيّر الإنتالبيا المعياريّة، ΔH0، في تفاعل حرق 1 مول C25H52(g)؟- 15,565kJ+
- 15,565kJ-
- 77,825kJ+
- 77,825kJ-
- أمامكم التفاعلات (1) – (3):
(1) C(s) + 2H2(g) → CH4(g) ΔH01 = -74.8kJ
(2) C(s) + 2H2(g) + O2(g) → CH3OH(ℓ) ΔH02 = -238.9kJ
(3) CH4(g) + O2(g) → CH3OH(ℓ) ΔH03 =?ما هي قيمة ΔH03 للتفاعل (3)؟
- 313.7kJ-
- 313.7kJ+
- 164.1kJ-
- 164.1kJ+
- أجرى ط لا لّاب عدّة تجارب، غمسوا فيها أشرطة لِ 3 فلزّات مختلفة في محاليل تحوي أيونات فلزّات. في كلّ تجربة غمس الط لا لّاب شريطًا فلزّيًّا معيّنًا في محلول مائيّ حوى أيونات فلزّ آخر (وأيونات سالبة أيضًا).
الجدول الذي أمامكم يشير بالنسبة لكلّ واحدة من التجارب هل حدث فيها تفاعل (+) أو لم يحدث فيها تفاعل (-).יוני מתכות
מתכות
Ba2+(aq) Zn2+(aq) Pb2+(aq) باريوم Ba(s) + + زنك Zn(s) – + رصاص Pb(s) – – ما هو الترتيب الصحيح لأيونات الفلزّات حسب قدرتها على الأكسدة؟
- Zn2+(aq) > Pb2+(aq) > Ba2+(aq)
- Ba2+(aq) > Zn2+(aq) > Pb2+(aq)
- Pb2+(aq) > Zn2+(aq) > Ba2+(aq)
- Pb2+(aq) > Ba2+(aq) > Zn2+(aq)
- إلى وعاء مفتوح يحوي محلولََا لالًحامض الكبريتيك، H2SO4(aq)، يُدخِلون مغنيسيومًا، Mg(s).
كلّ الفلزّ مغموس في المحلول.
أمامكم معادلة صافية للتفاعل الذي يحدث.Mg(s) + 2H3O+(aq) → Mg2+(aq) +H2(g) +H2O(ℓ)
أمامكم قائمة متغيّرات تتعلّق بالتجربة:
I. كتلة غاز الهيدروجين.
II. مساحة السطح الخارجيّ للمغنيسيوم.
III. تركيز محلول حامضالكبريتيك.
IV. حجم الوعاء الذي يحدث فيه التفاعل.أيّ متغيّرين من القائمة يمكنهما أن يؤثّرا على وتيرة التفاعل؟
- I وَ II
- II وَ III
- III وَ IV
- I وَ IV
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأوا القطعة التي أمامكم، وأجيبوا عن البنود التي تليها حسب التعليمات (سؤال إلزاميّ – 20 درجة).
ارتفاع درجة حرارة الكرة الأرضيّة (الاحترار العالميّ) – التغيّر يبدأ في القطبين
احترار مناطق القطبين في الكرة الأرضيّة يحدث أسرع ممّا تنبّأ العلماء، وهو يدلّ على التغيّرات المناخيّة في العالَم. إحدى نتائج هذا الاحترار هي ذوبان سريع للكتل الجليديّة القارّيّة في چرينلاند، وهي جزيرة قريبة من القطب الشماليّ، وكذلك في أنتركتيكا، في القطب الجنوبيّ. يؤدّي ذوبان الكتل الجليديّة القارّيّة، بالإضافة إلى ارتفاع مستوى سطح البحر، إلى تغيير مسارات العواصف في مناطق أمريكا الشماليّة. الكتلة الجليديّة القارّيّة (glacier) هي تراكُم كبير وقديم لجليد تكوّن خلال آلاف السنوات من طبقات الثلج التي هطلت وتبلورت الواحدة فوق الأخرى. الكتلة الجليديّة التي تكوّنت على سطح اليابسة تزداد خلال السنوات وتتحرّك ببطء باتّجاه البحر. تشكّل الكتل الجليديّة القارّيّة مصدرًا هامًّا وأساسيًّا لمياه الشرب في أماكن كثيرة في الكرة الأرضيّة. تحوي الكتلة الجليديّة القارّيّة حوالي %99 من الجليد، H2O(s)، وحوالي %1 من ملوِّثات مختلفة من البحر ومن الهواء، وهذه الملوِّثات تحوي أيونات مثل: الصوديوم، Na+، والمغنيسيوم، Mg2+، والكالسيوم، Ca2+، والكلور، Cℓ−، وأيونات كبريتيّة، SO42-. مصدر الأيونات هو من مركَّبات أيونيّة مختلفة ذابت في الماء. كتلة أيونات الصوديوم في 1 كغم من الكتلة الجليديّة هي 0.4×10-6 غرام. في أعقاب احترار الغلاف الجوّيّ في الآونة الأخيرة، تسخن أيضًا مياه المحيطات بوتيرة متزايدة. لذلك تنصهر قاعدة الكتلة الجليديّة القارّيّة الموجودة قريبًا من البحر الذي يسخن، وتسقط أجزاء كبيرة منها في المياه. أجزاء الكتلة الجليديّة القارّيّة التي تسقط في المياه تتحوّل إلى كتل جليديّة بحريّة عائمة (icebergs)، تنصهر وتؤدّي مع مرور الزمن إلى ارتفاع سطح البحر. الثلج والجليد هما مادّتان بيضاوان تعكسان معظم أشعّة الشمس إلى الفضاء. مياه المحيطات الأكثر غُمْقًا تستوعب أشعّة الشمس وتسخن. لذلك يوجد لذوبان جزء من الكتل الجليديّة تأثير مضاعف: – تزداد كتلة المياه التي تستطيع استيعاب الأشعّة وتسخن. – تقلّ كتلة الجليد، الذي يعكس أشعّة الشمس إلى الفضاء ويمنع الاحترار. في أعقاب ارتفاع درجة حرارة الهواء وذوبان الكتل الجليديّة، يحوي الهواء في القطبين كمّيّات أكبر من بخار الماء، وتتكوّن كمّيّة أكبر من الغيوم الماطرة، لذلك نشهد انتشارًا أكبر للعواصف الماطرة التي يرافقها البرق. تحوي الغيوم الماطرة عددًا هائ لا لامًن جزيئات الماء. على أثر حركة جزيئات الماء، يمرّ تيّار إلكترونات في الهواء بين الغيوم أو بين الغيمة والأرض، ويُحوِّل الجزيئاتالتي في الهواء إلى جسيماتمشحونة وإلى ذرّاتفرديّة. هذا الانتقال للإلكتروناتيرافقه انطلاق طاقة كثيرة تؤدّي إلى ارتفاع درجة حرارة الهواء في البيئة المحيطة القريبة إلى 30,000°C. نتيجة لانتقال الطاقة، نرى البرق، وهو عبارة عن بريق أبيض لامع، ونسمع الرعد الذي يتسببّ من انتشار سريع للهواء الساخن. اكتشف علماء كيمياء أنهّ أثناء تكونُّ البرق يمكن اكتشاف ذراّت أوكسجين وذراّت هيدروجين فرديةّ في الهواء؛ مصدر هذه الذراّت من جزيئات الماء التي في الغيوم. هناك برق يصيب موادّ قابلة للاشتعال موجودة على سطح الأرض ويؤديّ في أحيان متقاربة إلى حرائق. المعلومات المتعلقّة بالتغيرّات التي تطرأ على عالمنا وفهمها، تمكنّ العلماء من تنبؤّ التأثيرات المناخيةّ والاستعداد المسبق لمنع المسّ بالحياة وتقليص الأضرار.المصدر:
https://climate.nasa.gov/news/3062/warming-seas-are-accelerating-greenland-glacier-retreat/
| أجيبوا عن البنود “أ”، “ب”، “د”، “ﻫ”، “و”، “ز” وعن أحد البندين “ﺠ” أو “ﺤ”. |
- اكتبوا صيغًا لِ 4 مركَّبات أيونيّة يمكن أن تشكّل مصدرًا للأيونات الموجودة في الكتل الجليديّة.
في شماليّ الكرة الأرضيّة، تركيز أيونات الصوديوم في مياه البحر هو 0.46.
- بِكَم ضعفًا كتلة (מסה) أيونات الصوديوم في 1 لتر من مياه البحر هي أكبر بالمقارنة مع كتلة أيونات الصوديوم في 1 كغم من الكتل الجليديّة؟ فصِّلوا حسا باتكم.
| البند “ﺠ” هو بند اختياري. إذا اخترتُم الإجابة عنه، لا تجيبوا عن البند “ﺤ”. |
- النموذج في المخطّط الذي أمامكم يمثّل قطعة لترتيب جزيئات الماء في الجليد.

- تمعّنوا في النموذج، وحدِّدوا بِكَم ذرّة هيدروجين ترتبط كلّ ذرّة أوكسجين وبأيّة أنواع أربطة.
- اكتبوا معادلة عمليّة انصهار الجليد.
- أمامكم قولان: I وَ II . حدِّدوا بالنسبة لكلّ قول إذا كان صحيحًا أم غير صحيح.
- لذرّات جزيئات الماء في الجليد توجد مميّزات حركة من نوع اهتزاز فقط.
- لجزيئات الماء في الجليد توجد مميّزات حركة من نوع انزلاق فقط.
- حدِّدوا هل عمليّة انصهار الجليد في الكتلة الجليديّة القارّيّة هي عمليّة إندوثيرميّة أم إكسوثيرميّة.
فسِّروا واعتمِدوا في إجابتكم على أنواع القوى التي تعمل بين الجزيئات. - كتلة جليديّة كتلتها 2 طنّ سقطت في الماء وانصهرت بأكملها. كم جزيء ماء أُضيف إلى البحر؟ فصِّلوا حساباتكم.
معطى أنّ: 1 طنّ = 1×106 غرام. - أمامكم ثلاثة أقوال: I وَ II وَ III . اعتمِدوا على المقال العلميّ، وحدِّدوا بالنسبة لكلّ واحد من الأقوال إذا كان صحيحًا أم غير صحيح.
- أثناء حدوث البرق تنكسر أربطة تساهميّة )كوڤلنتيّة( بين الذرّات في جزيئات الماء الموجودة في الغيوم.
- أثناء حدوث البرق تنكسر أربطة تساهميّة بين الذرّات في الجزيئات الموجودة في الهواء.
- يؤثّر البرق على الغلاف الجوّيّ للبيئة، فقط عندما يصيب الأرض.
| البند “ﺤ” هو بند اختياري. إذا اخترتُم الإجابة عنه، لا تجيبوا عن البند “ﺠ”. |
- أثناء حدوث البرق تنكسر أربطة تساهميّة (كوڤلنتيّة) بين الذرّات في جزيئات الماء الموجودة في الغيوم.

- ما هي حالة المادّة للماء في كلّ واحدة من الحالات: c ، b ، a؟
- فسِّروا لماذا انتقال الطاقة d–c هو أكبر من انتقال الطاقة b–a.
الفصل الثاني (60 درجة)
أجيبوا عن ثلاثة מן الأسئلة 14-10 (لكل سؤال 20 درجة).
10. مبنى الذرّة، المبنى والترابط، الحسابات
تُزوِّد البطّاريّات طاقة للكثير من الأجهزة. تحوي البطّاريّات مركَّبات أيونيّة ومحاليل تحوي أيونات متحرّكة وموادّ إضافيّ.
كان الليثيوم، Li(s)، مركِّبًا حيويًّا في بطّاريّات الليثيوم الأولى.
- صفوا مبنى الليثيوم، Li(s)، وفسِّروا لماذا هذه المادّة موصِلة للكهرباء في درجة حرارة الغرفة.
في البطّاريّات التي لا تعتمد على الليثيوم، المُذيب هو الماء، لكنّ المذيبات في بطّاريّات الليثيوم ليست مائيّة.
أمامكم التفاعل التالي:
Li(s) + H2O(ℓ) → H2(g) + Li+(aq) +OH–(aq) ΔH0 <0
- فسِّروا لماذا لا يستعملون الماء مذيبًا في بطّاريّات الليثيوم.
أحد المذيبات في بطّاريّات الليثيوم هو ثنائيّ مثيل كربونات (DMC).
أمامكم تمثيل مختصر للصيغة البنائيّة لجزيء DMC:
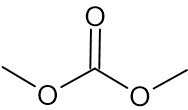
- اكتبوا صيغة جزيئيّة ﻟِ DMC.
أمامكم تمثيلات مختصرة للصِّيَغ البنائيّة لثلاثة جزيئات إضافيّة:
- أيّ جزيء أو أيّة جزيئات هي إيزوميرات ﻟِ DMC؟ فسَّروا اختياركم.
- درجة حرارة غليان DMC هي أقلّ من درجة حرارة غليان الماء في نفس الشروط. فسَّروا هذه الحقيقة.
- أذابوا 139 غرام DMC في الماء وحضّروا 1 لتر محلول.
- فسَّروا لماذا يذوب DNC في الماء.
- احسبوا التركيز المولاريّ للمحلول الذي تمّ تحضيره.
بطّاريّات الليثيوم القابلة للشحن تُسمّى بطّاريّات ليثيوم-أيون، וوتُستعمَل، من ضمن استعمالات أخرى، لتشغيل السيّارات الكهربائيّة.
توجد بطّاريّات ليثيوم-أيون تعتمد على مركَّبات ليثيوم، مثل أكسيد ليثيوم كوبلت، LiCoO2(g).
المركَّب الأيوني LiCoO2(g) مركَّب من أيونات ليثيوم، وأيونات كوبلت، Co3+، وأيونات أوكسجين، O2-.
- اكتبوا صيغتَي تمثيل إلكترونيّتين لأيونات الليثيوم ولأيونات الأوكسجين.
11. الأحماض الدهنيّة، المبنى والترابط، الحسابات
توجد في بذور الكاكاو زبدة كاكاو وموادّ صلبة للكاكاو. زبدة الكاكاو تحوي دهنًا. الموادّ الصلبة للكاكاو تحوي موادّ ليست دهنًا.
بعد معالجة ملائمة لبذور الكاكاو يُنتِجون منها شوكولاطة.
الشوكولاطة هي خليط لزبدة الكاكاو والموادّ الصلبة للكاكاو ومركِّبات أخرى كالسكّر ومواد طعم بمقادير مختلفة.
توجد في زبدة الكاكاو تريچليسيريدات مركَّبة أساسًا من ثلاثة الأحماضالدهنيّة المعروضة في الجدول 1:
| الحامض الدهنيّ | الرمز | יتمثيل مختصر للصيغة البنائيّة |
| حامضالپلميتيك | P | 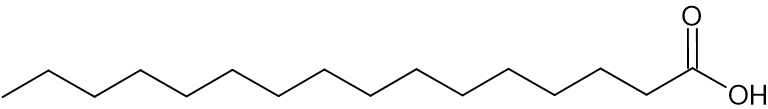 |
| حامضالستاريك | S | |
| حامضالأولييك | O |
الجدول 1
- اكتبوا كتابة مختصرة لكلّ واحد من الأحماضالدهنيّة المعروضة في الجدول 1.
- درجة حرارة انصهار حامضالپلميتيك هي أقلّ من درجة حرارة انصهار حامضالستاريك. ما هو سبب ذلك؟
زبدة الكاكاو تحوي أحماضًا دهنيّة إضافيّة بكمّيّات قليلة، منها الأحماضالدهنيّة المسجَّلة في الجدول 2:
| الحامض الدهنيّ | كتابة مختصرة للحامض الدهنيّ |
| حامضالميريستيك | C14:0 |
| حامضاللينولييك | C18:2ω6 cis, cis |
| حامضاللينولينيك | C18:3ω3 cis, cis, cis |
| حامضالأراكيديك | C20:0 |
الجدول 2
- اكتبوا لامًختصرًا للصِّيَغ البنائيّة للأحماضالدهنيّة غير المشبعة المسجَّلة في الجدول 2.
- درجة حرارة انصهار حامضالأولييك هي أعلى من درجة حرارة انصهار حامضاللينولييك. ما هو سبب ذلك؟
من الأحماض الدهنيةّ الأخرى في زبدة الكاكاو هو حامض الپلميتولييك. الكتابة المختصرة لهذا الحامض هي C16:1ω7 cis.
- اكتبوا تمثيلاً كاملاً للصيغة البنائيّة لجزيء حامض الپلميتولييك.
رموز التريچليسيريدات في زبدة الكاكاو هي: POP, SOS, POS.
أمامكم تمثيل مختصر للصيغة البنائيّة لجزيء تريچليسيريد:
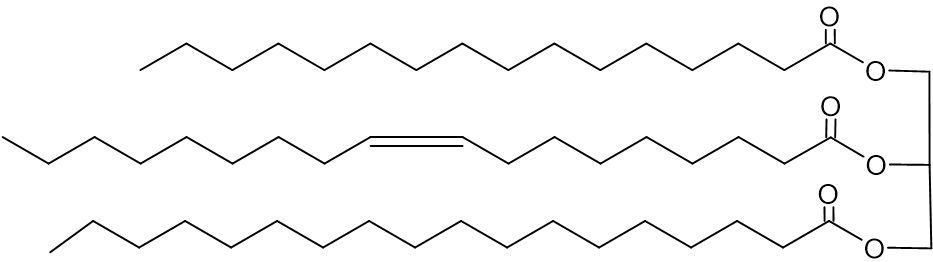
- اختاروا الرمز الملائم للتمثيل المختصر للصيغة البنائيّة المعطاة.
أمامكم تمثيل مختصر للصيغة البنائيّة لثلاثة جزيئات:
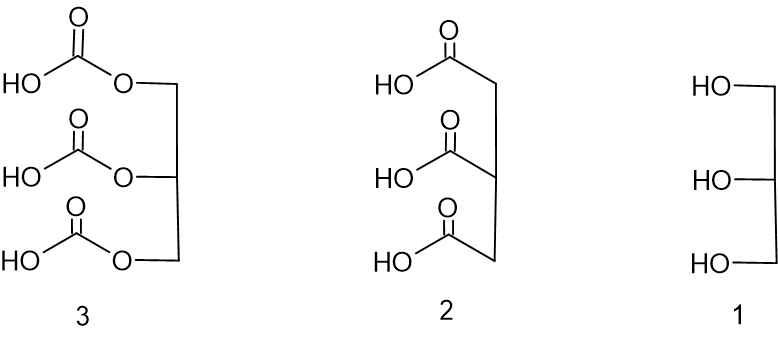
- أيّ تمثيل مختصر من هذه التمثيلات الثلاثة يلائم التمثيل المختصر للصيغة البنائيّة لجزيء الچليسيرول؟
الموادّ الصلبة للكاكاو التي في الشوكولاطة تحوي، من ضمن موادّ أخرى، المادّتين المنشّطتين ثيوبرومين وكفائين.
أمامكم تمثيل مختصر للصيغتين البنائيّتين لجزيء الثيوبرومين، C7H8N4O2، ولجزيء الكفائين، C8H10N4O2.

- فسِّروا لماذا تذوب المادّتان ثيوبرومين وكفائين في زبدة الكاكاو.
- أمامكم معطيات عن تركيز الكفائين في مشروبات مختلفة.

يُحبَّذ استهلاك ما لا يزيد عن 400 ملغرام من الكفائين في اليوم. شرب أحد الط لا لاب 4 عُلَب من مشروب طاقة في يوم واحد.- ما هي كتلة الكفائين في علبة واحدة من مشروب الطاقة؟ فصِّلوا حساباتكم.
- حدِّدوا هل تَجاوَزَ الطالبالاستهلاك اليوميّ الموصى به للكفائين (بافتراضأنّ هذا المشروبكان مصدر الكفائين الوحيد). فصِّلوا حساباتكم.
معطيات: 1×10-3M = 1mM
1 ملغرام = 10-3×1 גרם
حجم علبة المشروب = 330 ملل
12. الحوامض والقواعد
أمامكم 3 كؤوس كيميائيّة، كلّ واحدة منها تحوي لامًختلفًا.
غمسوا في كلّ واحد من المحاليل ورقة لكموس ورديّة وكذلك ورقة لكموس زرقاء. كما وفحصوا في كلّ واحد من المحاليل قيمة ال pH والتوصيل الكهربائيّ.
وُجد في كلّ واحدة من الكؤوس أنّ:
- لون ورقتَي اللكموس في المحلول هو ورديّ.
- قيمة pH المحلول هي 2 .
- المحلول موصِل للكهرباء.
معطى: في الجدول الذي أمامكم أُشير إلى لون أوراق اللكموس التي غُمست في محاليل مختلفة.
| في محلول حامضيّ | في محلول متعادل | في محلول قاعديّ | |
| ورقة لكموس ورديّة | لا يوجد تغيّر | لا يوجد تغيّر | يُغيِّر اللون إلى أزرق |
| ورقة لكموس زرقاء | يُغيِّر اللون إلى ورديّ | لا يوجد تغيّر | لا يوجد تغيّر |
- א
- اذكروا جميع أنواع الجسيمات الموجودة في كلّ واحد من المحاليل التي في الكؤوس 3-1.
- لماذا كلّ واحد من المحاليل موصِل للكهرباء؟
- لماذا قيمة ال pH متطابقة في جميع الكؤوس؟
إلى كلّ واحدة من الكؤوس أضافوا محلول هيدروكسيد الصوديوم، NaOH(aq), ، بأحجام وبتراكيز مختلفة، كما هو مفصَّل أمامكم.
إلى الكأس 1 – أضافوا 50 ملل من محلول NaOH(aq) بتركيز 0.02M.
إلى الكأس 2 – أضافوا 50 ملل من محلول NaOH(aq) بتركيز 0.01M.
إلى الكأس 3 – أضافوا 100 ملل من محلول NaOH(aq) بتركيز 0.02M.
بعد الإضافة، نتج محلول صافٍ (غير عَكِر) في كلّ واحدة من الكؤوس.
غمسوا ورقة لكموس ورديّة في كلّ واحدة من الكؤوس.
- בב
- اكتبوا معادلة صافية للتفاعل الذي حدث في كلّ واحدة من الكؤوس.
- اكتبوا معادلة صافية للتفاعل الذي حدث في كلّ واحدة من الكؤوس.
- حدِّدوا هل ال pH كان أصغر من 7 أم مساويًا لِ 7 أم أكبر من 7 في كلّ واحدة من الكؤوس بعد إضافة محلول هيدروكسيد الصوديوم.
- أُجريت تجربتان
التجربة 1
قاسوا ال pH لِ 100 ملل من محلول H2SO4(aq) بتركيز 0.2M.
أضافوا إلى هذا المحلول 100 ملل من محلول HCℓ(aq) بتركيز 0.2M وخلطوا المحلولين.
في نهاية الخلط، فحصوا ال pH مرّة ثانية.- حدِّدوا إذا كان ال pH في نهاية الخلط أعلى من ال pH الابتدائيّ أم أصغر منه أم مساويًا له؟ علِّلوا أو فصِّلوا حساباتكم.
التجربة 2
قاسوا ال pH لِ 100 ملل من محلول HCℓ(aq) بتركيز 0.1M.
أضافوا إلى هذا المحلول 100 ملل من محلول NaCℓ(aq) بتركيز 0.1M وخلطوا المحلولين.
في نهاية الخلط، فحصوا ال pH مرّة ثانية.
- حدِّدوا إذا كان ال pH في نهاية الخلط أعلى من ال pH الابتدائيّ أم أصغر منه أم مساويًا له؟ علِّلوا أو فصِّلوا حساباتكم.
13. الأكسدة – ا اختزال، المبنى والترابط والحسابات
يتناول السؤال فلزّ التيتانيوم، Ti(s)، وسبائكه. لهذا الفلزّ ولسبائكه استعمالات كثيرة في الصناعة، منها في صناعة الطيران والفضاء.
من أجل إنتاج التيتانيوم يستعملون معادن (מחצבים) تحوي أكسيد التيتانيوم، TiO2(s).
يتمّ إنتاج التيتانيوم في مرحلتين:
المرحلة الأولى
في هذه المرحلة يتفاعل أكسيد التيتانيوم، TiO2(s)، مع الكربون، C(s)، ومع غاز الكلور، Cℓ2(g).
أحد النواتج هو السائل، TiCℓ4(ℓ)، حسب التفاعل (1)
(1) TiO2(s) + C(s) + Cℓ2(g) → TiCℓ4(ℓ) + CO2(g)
المرحلة الثانية
المركَّبالسائليّ رباعيّ كلوريد التيتانيوم، TiCℓ4(ℓ)، الذي نتج في التفاعل (1)، يتفاعل مع المغنيسيوم الفلزّيّ، Mg(s), حسب التفاعل (2).
(2) TiCℓ4(ℓ) + 2Mg(s) → Ti(s) + 2MgCℓ2(s)
معطى أنّ: السالبيّة الكهربائيّة للتيتانيوم، Ti – 1.54.
- حدِّدوا ما هي المادّة المؤكسِدة وما هي المادّة المختزِلة في كلّ واحد من التفاعلين (1) وَ (2). علِّلوا تحديدكم.
- أيّ فلزّ هو مختزِل أفضل – المغنيسيوم أم التيتانيوم؟ علِّلوا إجابتكم.
- كم طنًّا من أكسيد التيتانيوم، TiO2(s)، يلزم لإنتاج طنّ واحد من فلزّ التيتانيوم، Ti(s)؟ فصِّلوا حساباتكم.
معطى أنّ: 1 طنّ = 106 × 1 غرام - إحدى السبائك المستعمَلة في صناعة الفضاء والطيران تَنتُج من معالجة الفلزّات تيتانيوم، Ti(s) ، وڤاناديوم، V(s)، وألومنيوم، Aℓ(s).
في 100 غرام من هذه السبيكة، يوجد 90 غرام تيتانيوم، وَ 4 غرام ڤاناديوم والباقي ألومنيوم.- أمامكم قائمة لأنواع جسيمات: ذرّات، جزيئات، أيونات، أيونات متحرّكة، إلكترونات متحرّكة.
أيّة أنواع جسيمات من هذه القائمة تُركِّب السبيكة؟ - كم مول إلكترونات يوجد في 1 كغم من هذه السبيكة؟ فصِّلوا حساباتكم.
- أمامكم قائمة لأنواع جسيمات: ذرّات، جزيئات، أيونات، أيونات متحرّكة، إلكترونات متحرّكة.
عندما يحضّرون سبائك التيتانيوم يجب صهره. التيتانيوم المنصهر يمكنه أن يتفاعل مع الغازات التي في الهواء.
- في التفاعل بين التيتانيوم المنصهر وبين غاز النيتروجين، N2(g)، الذي في الهواء يَنتُج المركَّبنترات التيتانيوم، TiN(s).
اكتبوا معادلة موازَنة لهذا التفاعل. - يصنِّعون (يعالجون) التيتانيوم المنصهر في بيئة لغاز الآرچون، Ar(g). فسِّروا لماذا.
- ذُكرت في بنود السؤال الموادّ: Ti(s), TiO2(s), TiCℓ4(ℓ), TiN(s).
حدِّدوا في أيّة ما دّة من هذ ه الموادّ ي ستطيع ال تيتانيوم أ ن يتفاعل كمختزِل فقط.
14. المبنى والترابط، الأكسدة وا اختزال، الحوامض والقواعد
الجدول الذي أمامكم يعرضمعطيات عن ثلاثة عناصر أُشير إليها اعتباطيًّا بالأحرف: c, b, a.
| رمز اعتباطيّ للعنصر | درجة حرارة انصهار العنصر (C°) | درجة حرارة غليان العنصر (C°) | التوصيل الكهربائيّ للعنصر في درجة حرارة الغرفة |
| a | 98 | 883 | موصِل |
| b | 259- | 253- | غير موصِل |
| c | 7- | 59 | غير موصِل |
- لائموا بين العناصر: هيدروجين، H2(g)، بروم، Br2(ℓ)، صوديوم، Na(s) وبين الأحرف c, b, a.
- ב
- حدِّدوا ما هو نوع الأربطة بين ذرّات العنصر المشار إليه بالحرف b.
- فسِّروا لماذا درجة حرارة غليان العنصر المُشار إليه بالحرف c هي أعلى من درجة حرارة غليان العنصر المشار إليه بالحرف b.
في شروط ملائمة، تتفاعل العناصر فيما بينها.
- في التفاعل بين العنصر المشار إليه بالحرف a وبين العنصر المشار إليه بالحرف b يَنتُج ناتج وحيد يكون صلبًا في درجة حرارة الغرفة.
ما هي درجة تأكسد كلّ واحد من الجسيمات في الناتج الذي نتج؟ - في التفاعل بين العنصر المشار إليه بالحرف a وبين العنصر المشار إليه بالحرف c يَنتُج ناتج وحيد يكون صلبًا في درجة حرارة الغرفة.
هذا الناتج يذوب في الماء.- اكتبوا معادلة إذابة الناتج في الماء.
- هل المحلول الناتج موصِل للكهرباء؟ علِّلوا إجابتكم.
- في التفاعل بين العنصر المشار إليه بالحرف b وبين العنصر المشار إليه بالحرف c يَنتُج ناتج وحيد يكون غازًا في درجة حرارة الغرفة.
هذا الناتج يتفاعل مع الماء ويَنتُج محلول.- ما هي صيغة الناتج؟
- اكتبوا معادلة تفاعل الناتج مع الماء.
- هل المحلول الناتج هو حامضيّ أم قاعديّ أم متعادل؟ علِّلوا إجابتكم.
- عنصر النيتروجين، N2(g)، يتفاعل مع العنصر المشار إليه بالحرف b, ، ويَنتُج ناتج وحيد غازيّ. هذا الناتج يتفاعل مع الماء ويُنتِج لاقًاعديًّا.
- اكتبوا معادلة تفاعل إنتاج هذا الناتج.
- اكتبوا معادلة التفاعل بين الناتج الذي يَنتُج وبين الماء.
- عنصر النيتروجين، N2(g)، يتفاعل أيضًا مع العنصر المشار إليه بالحرف a, ويَنتُج ناتج وحيد.
اكتبوا صيغة الناتج في درجة حرارة الغرفة.
نتمنّى لكم النّجاح!