اقتراح حلّ المتحان البچروت في الكيمياء 2016
نوع الامتحان: بجروت للمدارس الثّانويّة
موعد الامتحان: صيف 2016
رقم النّموذج: 37381
ملاحق: 1. الترتيب الدوريّ
2. جدول السالبيّة الكهربائيّة
3. قوانين للحسابات
4. مجموعات وظيفيّة
الكيمياء
حسب خطّة الإصلاح: التّعلّم ذي المعنى
تعليمات للممتحَن
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان.
الفصل الأوّل – إلزاميّ – 40 درجة
الفصل الثاني – 60 درجة
لمجموع – 100 درجة - موادّ مساعدة يُسمح استعمالها: حاسبة (بما في ذلك الحاسبة البيانيّة)
- تعليمات خاصّة:
- انتبه: في الفصل الأوّل توجد تسعة أسئلة إلزاميّة.
في كلّ واحد من الأسئلة 1 – 8 معروضة أربع إجابات، عليك أن تختار الإجابة الصحيحة منها. عليك الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
في السؤال 9 عليك الإجابة عن جميع البنود. - في الفصل الثاني عليك الإجابة عن ثلاثة من ستّة أسئلة.
- انتبه: في الفصل الأوّل توجد تسعة أسئلة إلزاميّة.
اكتب في دفتر الامتحان فقط، في صفحات خاصّة، كلّ ما تريد كتابته مسوّدة (رؤوس أقلام، عمليّات حسابيّة، وما شابه).
اكتب كلمة “مسوّدة” في بداية كلّ صفحة تستعملها مسوّدة. كتابة أيّة مسوّدة على أوراق خارج دفتر الامتحان قد تسبّب إلغاء الامتحان!
التّعليمات في هذا النّموذج مكتوبة بصيغة المذكّر وموجّهة للممتحَنات وللممتحَنين على حدّ سواء.
الأسئلة
الفصل الأوّل (40 درجة)
أجب عن ثمانية الأسئلة 8-1 (لكلّ سؤال – 2.5 درجة).
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختر الإجابة الأكثر ملاءمة.
- أشر إلى الإجابات التي اخترتَها في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
- في كلّ سؤال، أشر بقلم حبر بِ X في المربّع الذي تحت الحرف (א-ד) الذي يدلّ على الإجابة التي اخترتَها.
- في كلّ سؤال يجب الإشارة إلى X واحد فقط.
- لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■.
- يُمنَع المحو بالتيپكس.
- انتبه: من الجدير الامتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلاً بالإشارة إلى الإجابات الصحيحة في نموذج الامتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- معطى نظيران من نظائر البوتاسيوم، 39K وَ 41K.
ما هو القول الصحيح؟- الشحنة النوويّة للنظير 41K أكبر من الشحنة النوويّة للنظير 39K.
- عدد الإلكترونات في النظير 41K أكبر من عدد الإلكترونات في النظير 39K.
- كتلة النظير 41K أكبر من كتلة النظيرפ 39K.
- نصف قطر النظير 41K أكبر من نصف قطر النظير 39K.
- نُدرِّج ثلاث ذرّات حسب طاقة تأيّنها.
ما هو التدريج الصحيح؟- F > Ne > Cℓ
- Ne > F > Cℓ
- F > Cℓ > Ne
- Ne > Cℓ > F
- الجدول الذي أمامك يعرض معلومات عن المبنى الفراغيّ لأربعة جزيئات.
الجزيء BF3 CH2O CS2 HCN المبنى الفراغيّ للجزيء مستوٍ ثلاثيّ مستوٍ ثلاثيّ خطيّّ خطيّّ لأيّ من الجزيئات المعطاة يوجد ثنائيّ تقاطب ثابت؟
- CS2 وَ HCN
- BF3 وَ CH2O
- CH2O وَ HCN
- BF3 وَ CS2
- أمامك تمثيل كامل للصيغة البنائيّة لجزيء الأستون:
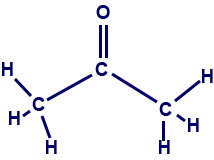 أمامك أربعة أقوال iv-i:
أمامك أربعة أقوال iv-i:- في الحالة السائليّة، بين جزيئات الأستون، توجد فقط تأثيرات متبادلة من نوع ڤان در ڤالس.
- في الحالة السائليّة، توجد بين جزيئات الأستون تأثيرات متبادلة من نوع ڤان در ڤالس وكذلك أربطة هيدروجينيّة.
- في المحلول المائيّ للأستون، توجد أربطة هيدروجينيّة بين جزيئات الأستون وجزيئات الماء.
- في المحلول المائيّ للأستون، توجد فقط تأثيرات متبادلة من نوع ڤان در ڤالس بين جزيئات الأستون وجزيئات الماء.
ما هما القولان الصحيحان؟
- i وَ iii
- i وَ iv
- ii وَ iii
- ii وَ iv
- خلطوا 1 لتر من محلول هيدروكسيد الصوديوم، Na(OH)(aq)، بتركيز 0.2M
مع 1 لتر من محلول مائيّ يحوي 0.2 مول إيثانول، CH3CH2(OH)(aq).
ما هو تركيز أيونات (OH)¯(aq) في المحلول الذي نتج؟- 0.1M
- 0.2M
- 0.3M
- 0.4M
- معطى محلولان مائيّان عديما اللون، A وَ B.
للمحلول pH=5 A
للمحلول pH=9 B
ما هو القول الصحيح؟- إضافة ماء إلى المحلول A تؤدّي إلى انخفاض pH المحلول.
- إضافة ماء إلى المحلول B تؤدّي إلى ارتفاع تركيز أيونات الهيدروكسيل، (OH)¯(aq)، في المحلول.
- لا يمكن التمييز بين المحلول A والمحلول B بواسطة الكاشف فينول فتالين.
- دَفْق غاز بروميد الهيدروجين، HBr(aq)، إلى المحلولين يؤدّي إلى انخفاض pH كلّ واحد من المحلولين.
- الخارصين، Zn(s)، تفاعَلَ مع المحلول X الذي يحوي أيونات هيدرونيوم، H3O+(aq)، حسب التفاعل:
Zn(s) + 2H3O+(aq) → Zn2+(aq) + H2(g) + 2H2O(ℓ)
نتج في هذا التفاعل 0.2 مول هيدروجين، H2(g).
أيّ محلول من المحاليل א-ד التي أمامك هو المحلول X؟- 200 ملل محلول 1M HCℓ(aq).
- 200 ملل محلول 2M HCℓ(aq).
- 200 ملل محلول 0.5M H2SO4(aq).
- 100 ملل محلول 1M H2SO4(aq).
- يتفاعل الهيدروجين، H2(g)، مع الفلور، F2(g)، حسب التفاعل:
1⁄2H2(g) + 1⁄2F2(g) → HF(g)
أمامك تخطيط يعرض تغيّرات الإنتالبيا في هذا التفاعل.
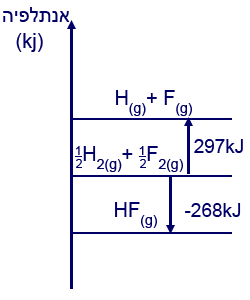 ما هي قيمة إنتالبيا الرباط H—F؟
ما هي قيمة إنتالبيا الرباط H—F؟- –268 kJ⁄moℓ
- +29 kJ⁄moℓ
- +297 kJ⁄moℓ
- +565 kJ⁄moℓ
تحليل قطعة من مقال علميّ – إلزاميّ
9. اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – د” التي تليها (سؤال إلزاميّ – 20 درجة).
الأسمدة النيتروجينيّة – نعمة بزيّ نقمة
النيتروجين هو أحد العناصر اللازمة لنموّ سليم للنباتات. غاز النيتروجين، N2(g)، هو مركِّب أساسيّ في الهواء، لكنّ النباتات لا تستطيع استغلاله مباشرةً. تستوعب النباتات النيتروجين اللازم لنموّها من التربة، على شكل أيونات أمونيوم، NH4+(aq)، أو على شكل أيونات نيترات، NO3‾(aq).
قبل حوالي مئة سنة وجد الكيميائيّ پريتس هابر الشروط التي يتفاعل فيها النيتروجين الذي في الهواء، N2(g)، مع الهيدروجين، H2(g). في هذا التفاعل ينتج غاز الأمونيا، NH3(g). يمكن من الأمونيا إنتاج موادّ كثيرة، منها أسمدة نيتروجينيّة اصطناعيّة مثل نترات الأمونيوم، NH4NO3(s),، ونترات البوتاسيوم، KNO3(s), ، اللذين يزوّدان النباتات بالنيتروجين اللازم لنموّها.
منذ أن بدأوا بإنتاج الأسمدة الاصطناعيّة واستعمالها، ازدادت كمّيّة المحاصيل الزراعيّة، وازدادت كمّيّة الغذاء في العالم.
حصل پريتس هابر على جائزة نوبل في الكيمياء عام 1918, على مساهمته للبشريّة بفضل هذا الاكتشاف.
إ لا لا أنّه وُجد أنّ النباتات تستوعب فقط حوالي نصف كمّيّة الأسمدة النيتروجينيّة التي تُضاف إلى التربة.
تذوب الأسمدة في الماء جيّدًا وتُستوعَب بواسطة النباتات. الفضلات التي تتبقّى في التربة يمكنها أن تتغلغل إلى مصادر مياه الشرب وأن تزيد تركيز أيونات NO3‾(aq) فيها إلى مدًى أكبر من المسموح به، وبذلك تُسبِّب أضرارًا صحّيّة.
توجد في التربة بكتيريا تُحوِّل أيونات NO3‾ إلى جزيئات N2 في عمليّة متعدّدة المراحل تُسمّى نزع النيتروجين (דֵנִיטְרִיפִיקַצְיָה).
الجسيمات التي تنتج في المراحل المختلفة لعمليّة نزع النيتروجين معروضة في التخطيط التالي:
NO3‾ → NO2‾ → NO → N2O → N2
نزع النيتروجين بواسطة البكتيريا لا يقلّص بالمدى المرغوب فيه تركيز أيونات NO3‾(aq) التي مصدرها من التسميد والتي تتغلغل إلى مياه الشرب، لذلك يبحث الكيميائيّون عن طرق إضافيّة لذلك.
في إحدى الطرق التي تمّ تطويرها مؤخّرًا، يستعمل الكيميائيوّن النانو-تكنولوجيا من أجل تحويل مباشر لأيونات NO3‾(aq) إلى N2(g)، وبذلك يقلّصون بمدًى ملحوظ الإضرار بجودة مياه الشرب.
المصادر:
א”ר טאונסנד ור”ו הווארתס, “תיקונה של בעיית החנקן בעולם” סיינטיפיק אמריקן ישראל, יוני 2010.
https://www.utwente.nl/en/news/!/2015/1/357005/nanoparticles-for-clean-drinking-water
https://en.wikipedia.org/wiki/Denitrification
- حسب القطعة، اكتب معادلة موازَنة لتفاعل الحصول على NH3(g).
3H2(g) + N2(g) → 2NH3(g)
- حسب القطعة، اذكر إيجابيّة واحدة وسلبيّة واحدة لاستعمال الأسمدة النيتروجينيّة الاصطناعيّة.
יתרון – הדשנים מספקים לצמח יונים שונים המכילים גם אטומי חנקן. בצמח מתרחשים תהליכים בהם נדרשים אטומי חנקן.
חסרון – עודף יונים מחלחלים באדמה ופוגעים במי השתייה ובבריאות האדם. - ذُكر في القطعة السماد نترات الأمونيوم، NH4NO3(s).
- محلول السماد NH4NO3(s) ينتج في تفاعل بين NH3(g)
ومحلول مركَّز لِ HNO3(aq)، حسب التفاعل:NH3ׂ(g) + HNO3(aq) → NH4+(aq) + NO3‾(aq)
حدِّد إذا كان هذا التفاعل تفاعل أكسدة – اختزال أم تفاعل حامض – قاعدة. علّل.
מדובר בתגובת חומצה בסיס שבה NH3(g) (בסיס) קולט פרוטון (+H), ו- HNO3(aq) (חומצה), מוסרת פרוטון.
فسّر لماذا المركَّب NH4NO3(s) هو صلب في درجة حرارة الغرفة.
החומר NH4NO3(s) מוצק בטמפרטורת החדר, כי מדובר במבנה ענק שלו סריג יוני המורכב מיונים חיוביים ויונים שליליים, בין היונים בעלי המטענים המנוגדים יש משיכה חשמלית חזקה, לחומר טמפרטורת היתוך גבוהה מטמפרטורת החדר (אים בטמפרטורת החדר מספיק אנרגיה לפירוק הקשרים) והקשרים לא ניתקים בטמפרטורת החדר.فسّر لماذا المركَّب NH4NO3(s) يمكن أن يُستعمَل سمادًا.
התרכובת NH4NO3(s) יכולה לשמש כדשן, כי זה חומר יוני קל תמס ולכן, במגע עם מים נוצרים יוני NH4+(aq) ו- NO3‾(aq) שהצמחים קולטים.
- محلول السماد NH4NO3(s) ينتج في تفاعل بين NH3(g)
- ד
- حدِّد درجة تأكسد ذرّات N في كلّ واحد من خمسة الجسيمات التي تشترك في المراحل المختلفة لعمليّة نزع النيتروجين.
- من أجل تحويل أيونات NO3‾(aq) إلى N2(g)، تحتاج بكتيريا نزع النيتروجين إلى مادّة تحوي جزيئاتها ذرّات كربون، C.
أيّ من المادّتين تلائم ذلك: ثاني أكسيد الكربون، CO2(g)، أم ميثانول، CH3OH(ℓ)؟
علّل.
בתגובה שבה NO3‾(aq) הופך ל- N2(g), החנקן (N) יורד בדרגת החמצון מ- 5+ ל- 0, ולכן עובר חיזור.
כעת צריך לבדוק את הפחמן, נבדוק האם הפחמן יכול לעבור חמצון.
בחומר הפחמן בד”ח מקסימלית, ולכן לא יכול לעבור תהליך חמצון.
בחומר הפחמן בד”ח ביניים, ולכן יכול למסור אלקטרונים ולעבור חמצון.לכן, החומר שיגיב הוא מתאנול, CH3OH(ℓ).
- حدِّد درجة تأكسد ذرّات N في كلّ واحد من خمسة الجسيمات التي تشترك في المراحل المختلفة لعمليّة نزع النيتروجين.
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 14-10 (لكلّ سؤال – 20 درجة)
10. المبنى والترابط
- تفاعَلَ بروم سائليّ، Br2(ℓ)، مع شريط مغنيسيوم، Mg(s). في التفاعل نتجت مادّة صلبة بيضاء من بروميد المغنيسيوم، MgBr2(s).
- اكتب معادلة موازَنة للتفاعل الذي حدث.
Mg(s) +Br2(ℓ) → MgBr2(s)
- الجدول الذي أمامك يعرض معطيات جزئيّة عن الموادّ التي تشارك في التفاعل الذي كتبتَه في البند الفرعيّ “أi”.
انسخ الجدول إلى دفترك، وأكمل المعطيات الناقصة فيه.
المادّة نوع الجسيمات
في المادّةصيغة تمثيل إلكترونيّة
لجسيمات المادّةنوع الأربطة بين
الجسيماتBr2(ℓ) מולקולות 
تأثيرات متبادلة من
نوع ڤان در ڤالسMgBr2(s) יונים חיוביים Mg2+,
יונים שליליים Br ‾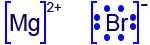
יוני / משיכה חשמלית בין
היונים החויביים והשליליים
Mg(s) أيونات موجبة
في “بحر من
الإلكترونات”מתכתי / משיכה חשמלית בין הקטיונים (החיוביים)
לאלקטרונים השליליים
- اكتب معادلة موازَنة للتفاعل الذي حدث.
- أجرى بعض الط لا لاب تجربة في المختبر.
إلى كأس حَوَتْ 100 ملل ماء، أضاف الط لا لاب بالتدريج المادّة الصلبة بروميد المغنيسيوم ، MgBr2(s).
بعد كلّ إضافة خلط الط لا لاب محتوى الكأس جيّدًا، حتّى ذابت المادّة الصلبة بالكامل.
في كلّ مرّة قاس الط لا لاب التوصيل الكهربائيّ للمحلول.
حجم المحلول أثناء التجرية بقي ثابتًا.
نتائج التجربة معروضة بشكل تخطيطيّ في الرسم البيانيّ الذي أمامك.
- اكتب معادلة عمليّة إذابة بروميد المغنيسيوم، MgBr2(s) في الماء.
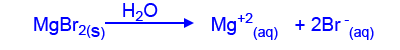
- فسّر نتائج التجربة المعروضة في الرسم البيانيّ.
ניתן לראות בגרף שככל שמסת המגנזיום הברומי שמוסיפים גדולה יותר, המוליכות החשמלית גדלה, כי בהוספת המוצק השריג היוני מתפרק ונוצרים יונים ממוימים ניידים. ככל שנוסיף יותר מוצק, יווצרו יותר יונים ניידים , ריכוז היונים הכולל יגדל, ולכן המוליכות החשמלית גדלה.
- اكتب معادلة عمليّة إذابة بروميد المغنيسيوم، MgBr2(s) في الماء.
- يتفاعل البروم، Br2(ℓ)، مع الإيثين، C2H4(g). ينتج السائل ثنائيّ – برومو إيثان C2H4Br2(ℓ).
اكتب تمثيلاً كاملاً للصيغة البنائيّة لكلّ واحد من الجزيئَيْن C2H4 وَ C2H4Br2.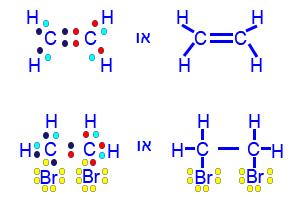
- في تجربة أخرى أدخل الط لا لاب ثنائيّ – برومو إيثان، C2H4Br2(ℓ)، إلى وعاءين A وَ B.
الوعاء A حوى ماءً، H2O(ℓ).
الوعاء B حوى هكسان، C6H14(ℓ).
فقط في أحد الوعاءين نتج خليط متجانس.
- حدِّد في أيّ من الوعاءين، A أم B، نتج خليط متجانس. علّل تحديدك.
תערובת הומוגנית נקבל בכלי B, כי בין מולקולות החומרים C2H4Br2(ℓ) ו- C6H14(ℓ) ישנן אינטראקציות ו.ד.ו, ולכן כשמוסיפים C2H4Br2(ℓ), ל- C6H14(ℓ) ניתקות חלק מאינטראקציות ה-ו.ד.ו. בין מולקולות ה- C2H4Br2(ℓ), אבל נוצריות אינטראקציות ו.ד.ו. בין מולקולות C6H14(ℓ) לבין מולקולות ה- C2H4Br2(ℓ). - حدِّد إذا كان الخليط المتجانس الذي نتج موصِلاً للكهرباء.
התערובת אינה מוליכה חשמל.
- حدِّد في أيّ من الوعاءين، A أم B، نتج خليط متجانس. علّل تحديدك.
11. كيمياء الغذاء
يتناول السؤال زيت النخيل، الذي يُستخلَص من ثمار أشجار النخيل (palm tree)، التي تنمو في المناطق الاستوائيّة.
يُستعمَل زيت النخيل، من ضمن استعمالات أخرى، في إنتاج الغذاء ومنتَجات التجميل.
الجدول الذي أمامك يعرض الحامضين الدهنيّين الأساسيّين اللذين يركِّبان التريچليسيريدات الموجودة في زيت النخيل.
| الحامض الدهنيّ | الرمز | تمثيل مختصر للصيغة البنائيّة | النسبة المئويّة |
| حامض الپلمتيك | P | CH3(CH2)14COOH | 44% |
| حامض الأولييك | O | 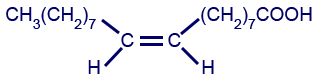 |
37% |
- א
- اكتب كتابة مختصرة لحامض الپلمتيك ولحامض الأولييك.
חומצה פלמיטית: C16:0
חומצה אולאית: C18:1ω9 cis - يحوي زيت النخيل نسبة مئويّة صغيرة من حامض الميريستيك: C14:0.
درجة حرارة انصهار حامض الميريستيك هي 54ºC.
حدِّد إذا كانت درجة حرارة انصهار حامض الپلمتيك أعلى من 54ºC أم أقلّ منها. علّل.
טמפרטורת ההיתוך של חומצה פלמיטית גבוהה מ- 54ºC, כי לחומצה פלמיטית ענן אלקטרונים גדול מהחומצה המיריסטית (שתיהן חומצות שומן רוויות), ולכן אינטראקציות הואן-דר-ואלס בין מולקולות החומצה הפלמיטית חזקות יותר, נדרשתאנרגיה רבה יותר לניתוק אינטראקציות אלה וטמפרטורת ההיתוך גבוהה יותר.
- اكتب كتابة مختصرة لحامض الپلمتيك ولحامض الأولييك.
- التريچليسيريدان PPP وَ OOO هما اثنان من التريچليسيريدات الموجودة في زيت النخيل.
- أمامك تمثيل مختصر للصيغة البنائيّة لجزيء چليسرول.
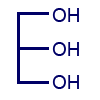 اكتب تمثيلاً مختصرًا للصيغة البنائيّة للتريچليسيريد PPP.
اكتب تمثيلاً مختصرًا للصيغة البنائيّة للتريچليسيريد PPP.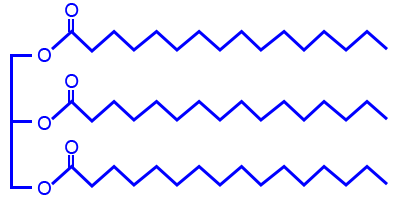
- التأثيرات المتبادلة بين جزيئات التريچليسيريد PPP أقوى من التأثيرات المتبادلة بين جزيئات التريچليسيريد OOO.
فسّر لماذا.
הטריגליצריד OOO מורכב מחומצות שומן לא רוויות במצב ציס באזור הקשר הכפול נוצר כיפוף / עיוות במבנה המולקולה, ולכן יכולת האריזה וההתארגנות של מולקולות הטריגליצריד OOO, פחות טובה / צפופה (שטח המגע בין המולקולות קטן יותר). ולכן האינטראקציות בין מולקולות הטריגליצריד OOO חלשות יותר.
- أمامك تمثيل مختصر للصيغة البنائيّة لجزيء چليسرول.
- زيت النخيل غنيّ بِبيتا-كروتين.
أمامك تمثيل مختصر للصيغة البنائيّة لجزيء بيتا-كروتين.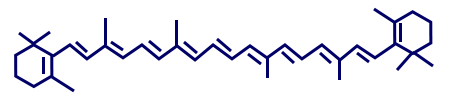 في جزيء بيتا-كروتين توجد أربطة C—H, وأربطة C—C, وأربطة C═C.
في جزيء بيتا-كروتين توجد أربطة C—H, وأربطة C—C, وأربطة C═C.
- الرباط C—H أقصر من الرباط C—C.
اذكر العوامل التي تؤثّر على ذلك.
לאטום המימן בקשר C—H פחות רמות אנרגיה מאוכלסות באלקטרונים (רדיוס קטן יותר), ובנוסף לכך הקשר C—H קוטבי ולכן המשיכה החשמלית שנוצרת בין האטומים (+δ ל- ‾δ) חזקה יותר, ולכן הקשר קצר יותר. - حدِّد أيّ رباط هو الأقوى: C—C أم C═C.
اذكر العامل المؤثِّر.
הקשר C═C חזק יותר כי סדר הקשר גדול יותר, יש לו קשר כפול לעומת קשר יחיד ב- C—C.
- الرباط C—H أقصر من الرباط C—C.
- يحوي زيت النخيل ڤيتامين E أيضًا.
الاستهلاك اليوميّ لڤيتامين E الموصى به لأبناء الشبيبة هو 15 ملغم (0.015 غرام).
في لتر واحد من زيت النخيل في الحالة السائليّة يوجد 0.00267 مول ڤيتامين E.
الكتلة المولاريّة لڤيتامين E היא 431 مول⁄غرام.
حدِّد إذا كان 1 ملل من زيت النخيل يمكن أن يزوّد الاستهلاك اليوميّ لڤيتامين E الموصى به لأبناء الشبيبة. فصّل حساباتك.
נפח מול ויטמין E 1000 מ”ל 0.00267 מול 1 מ”ל 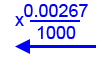
0.00000267 מול m = Mw ×n = 431 × 0.00000267 = ג’ 0.00115 = מ”ג 1.15
1.15 < 15הכמות לא מספיקה כדי לספק את כל הנדרש מויטמין E.
12. المبنى والترابط والأكسدة – الاختزال
أجرى بعض الط لا لاب تجارب في المختبر مع محلول مائيّ لكلوريد النحاس،, CuCℓ2(aq), وجود أيونات النحاس،, Cu2+(aq), في المحلول يُكسبه لونًا أزرق.
- طُلب من الط لا لاب أن يصفوا في المستوى الميكروسكوبيّ المحلول المائيّ لكلوريد النحاس.
أمامك الوصف الذي كتبه أحد الط لا لاب.ّّ
“المحلول المائيّ لكلوريد النحاس هو سائل لونه أزرق. في هذا المحلول توجد أيونات موجبة للنحاس، Cu2+(aq), وأيونات سالبة للكلور، Cℓ2‾(aq). الأيونات مُحاطة بجزيئات من الماء. الأيونات الموجبة تُكوِّن أربطة هيدروجينيّة مع جزيئات الماء. الأربطة الهيدروجينيّة تتكوّن أيضًا بين جزيئات الماء نفسها.”
- في هذا الوصف كتب الطالب نقطة واحدة لا تلائم وصف المحلول في المستوى الميكروسكوبيّ. اذكر هذه النقطة، واشرح لماذا هذه النقطة ليست ملائمة.
התמיסה בצבע כחול, זהו תיאור ברמה המאקרוסקופית, כי את זה רואים. - اذكر خطأَيْن في الوصف الميكروسكوبيّ الذي كتبه الطالب، واشرح لماذا كلّ واحد منهما هو خطأ.
התלמיד כתב שבתמיסה יוני Cℓ2‾(aq). זו טעות יש יוני Cℓ ‾(aq).
התלמיד כתב שהיונים יוצרים קשרי מימן עם מולקולות המים, זו טעות. בין מולקולות המים ליונים נוצרת משיכה חשמלית בין (O) δ‾ ליון חיובי, ובין (H) δ+ ליון השלילי. - اكتب نقطة واحدة كان يجب أن تُكتَب في الوصف الميكروسكوبيّ لمحلول CuCℓ2(aq)، ولم يكتبها الطالب.
ליונים ולמולקולות המים בתמיסה יש תנועה תנודתית וסיבוב.
- في هذا الوصف كتب الطالب نقطة واحدة لا تلائم وصف المحلول في المستوى الميكروسكوبيّ. اذكر هذه النقطة، واشرح لماذا هذه النقطة ليست ملائمة.
- في إحدى التجارب غمس الط لا لاب لوحة ألومنيوم، Aℓ(s)، في محلول CuCℓ2(aq).
حدث تفاعل أكسدة – اختزال بين Aℓ(s) وأيونات Cu2+(aq).
- اكتب معادلة موازَنة للتفاعل الذي حدث.
2Aℓ(s) + 3Cu2+(aq) → 2Aℓ3+(aq) + 3Cu(s)
- اذكر تغيّرين ظاهرين للعين خلال التجربة (مشاهَدَتَيْن).
הצבע הכחול ייעלם או יהפוך לבהיר יותר.
המוצק Aℓ(s) , הלוחית תיעלם או תקטן בגודלה, ויופיע מוצק חדש Cu(s) (צבעו שונה) שישקע. - حدِّد إذا كان اتّجاه انتقال الإلكترونات في التفاعل هو من ذرّات الألومنيوم إلى أيونات النحاس أم من أيونات النحاس إلى ذرّات الألومنيوم.
מאטומי האלומיניום ליוני הנחושת.
- اكتب معادلة موازَنة للتفاعل الذي حدث.
- ג
- غمس الط لا لاب لوحة فضّة، Ag(s), في محلول CuCℓ2(aq).
لم تُشاهَد تغيّرات تدلّ على حدوث تفاعل.
رتِّب الفلزّات: Cu(s) ، Ag(s) ، Aℓ(s) حسب قدرتها على الاختزال، من الأكبر إلى الأصغر. علّل.
Ag(s) לא הגיב עם יוני Cu2+(aq) בתמיסה, ולכן הוא מחזר פחות טוב מהנחושת Cu(s).
Cu2+(aq) הגיבו עם Aℓ(s) , ולכן Aℓ(s) מחזר טוב יותר, כי עברו אלקטרונים מה- Aℓ(s) ליוני הנחושת Cu2+(aq).
ולכן הסדר הנכון הוא:Aℓ(s) > Cu(s) > Ag(s)
- غمس الط لا لّاب لوحة Aℓ(s) في محلول يحوي أيونات Ag+(aq). حدِّد إذا شوهدت تغيّرات تدلّ على حدوث تفاعل. علّل.
תתרחש תגובה, נראה שהלוחית נעלמת או קטנה בגודלה (מגיבה). שכן Aℓ(s) מחזר טוב יותר מאשרAg(s) ולכן יעברו אלקטרונים מ- Aℓ(s) ליוני Ag+(aq).
- غمس الط لا لاب لوحة فضّة، Ag(s), في محلول CuCℓ2(aq).
13. الأحماض والقواعد والحسابات الكيميائيّة
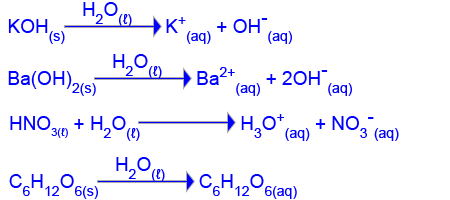
حضّروا في المختبر 4 محاليل مائيّة (1) – (4) بأحجام متساوية.
الجدول الذي أمامك يعرض معطيات عن هذه المحاليل.
| المحلول المائيّ | المادّة التي أُدخلت إلى الماء | تركيز المحلول (M) |
| (1) | KOH(s) | 0.01 |
| (2) | Ba(OH)2(s) | 0.01 |
| (3) | HNO3(ℓ) | 0.02 |
| (4) | C6H12O6(s) | 0.02 |
- א
- اكتب معادلة العمليّة التي تحدث عندما يُدخلِون على حِدة كلّ واحدة من الموادّ الأربع إلى الماء.
- درِّج المحاليل (1) – (4) حسب ال pH، من الأصغر إلى الأكبر.
2>1>4>3
- اكتب معادلة العمليّة التي تحدث عندما يُدخلِون على حِدة كلّ واحدة من الموادّ الأربع إلى الماء.
- عندما يضيفون حامض الأسيتيك، CH3COOH(ℓ)، إلى الماء يحدث التفاعل:
CH3COOH(ℓ) + H2O(ℓ) → H3O+(aq) + CH3COO ‾(aq)
- أضافوا محلولاً مائيًّا لحامض الأسيتيك، إلى المحلول (1) وإلى المحلول (4).
حدِّد في أيّ من المحلولين (1) או (4), حدث تفاعل. علّل تحديدك.
בתמיסה (1) התרחשה תגובה, כי התמיסה בסיסית ויוני ההידרוניום H3O+(aq) יגיבו עם יוני ה- OH ‾(aq). - اكتب معادلة صافية للتفاعل الذي حدث.
H3O+(aq) + OH‾(aq) → 2H2O(aq)
- أضافوا محلولاً مائيًّا لحامض الأسيتيك، إلى المحلول (1) وإلى المحلول (4).
أجرى بعض الط لا لاب تجربتين. في كلّ واحدة من التجربتين، أضافوا ثلاث موادّ صلبة مختلفة (A وَ B وَ C) إلى 100 ملل محلول لحامض النيتريك، 0.1M HNO3(aq).
كان الفرق بين التجربتين في ترتيب إضافة الموادّ الصلبة.
قاس الط لا لاب خلال التجربتين pH المحلول بعد إضافة كلّ واحدة من الموادّ الصلبة.
الموادّ الصلبة التي أضافها الط لا لاب في التجربتين:
المادّة الصلبة 0.56 – A غرام KOH(s)
المادّة الصلبة 1.71 – B غرام Ba(OH)2(s)
المادّة الصلبة 1.8 – C غرام C6H12O6(s)
- الرسم البيانيّ I الذي أمامك يعرض بشكل تخطيطيّ التغيّرات في ال pH أثناء التجربة الأولى.
الأزمنة التي أضافوا فيها ثلاث الموادّ الصلبة في التجربة الأولى مُشار إليها بِ t3 , t2 , t1.
- حدِّد ما هي المادّة الصلبة التي أضافوها في الزمن t1. فصّل حساباتك وعلّل.
בתמיסה יש
H3O+(aq) HNO3(aq) 1 : 1 יחס מולים 0.1 (נתון) V תמיסה
(ליטר)0.1 (נתון) C(M) 0.01 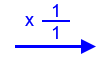
n=C×V
n=0.1×0.1=0.01n מול ניתן לראות שבדקה t1 ה- pH עלה. היות והוא עלה ל- 7 זה אומר שהייתה סתירה מלאה, שהוסיפו בדיוק 0.01 מול יוני (OH)¯(aq) , כי יוני (OH)¯(aq) מגיבים עם יוני H3O+(aq) ביחס של 1:1. ב- pH = 7 הסתירה מלאה היונים הגיבו בשלמות.
נבדוק את החומרים הבסיסיים:OH‾(aq) KOH(s) 1 : 1 יחס מולים 0.56 m (ג’) 56 Mw (ג’/מול) 0.01 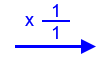
n = m⁄ Mw = 0.56 ⁄ 56 = 0.01 n מול ניתן לראות שכמות המולים של יוני ההידרוקסיד שייווצרו בהוספת 0.56ג’ KOH(s) היא 0.01, ולכן תהיה סתירה מלאה. ז”א המוצק שהוסיפו בזמן t1 הוא KOH(s).
- ما هي المادّة الصلبة التي أضافوها في الزمن t2؟ علّل.
בדקה t2 הוסיפו מוצק שלא שינה את ה- pH. המוצק הוא C6H12O6(s), סוכר, בהוספת המוצק לא נוצרים יוני הידרוניום, H3O+(aq), או יוני הידרוקסיד, (OH)¯(aq), ונפח התמיסה לא משתנה, לכן ה- pH נשאר = 7.
- حدِّد ما هي المادّة الصلبة التي أضافوها في الزمن t1. فصّل حساباتك وعلّل.
- في التجربة الثانية أضاف الط لا لاب ثلاث الموادّ الصلبة بترتيب آخر.
- الرسم البيانيّ II الذي أمامك يعرض بشكل تخطيطيّ التغيّرات في ال pH أثناء التجربة الثانية.

حدِّد ما هو ترتيب إضافة الموادّ الصلبة في التجربة الثانية.
כמו שהסברנו בסעיף גi, החומר הראשון שהוסיפו גרם לסתירה מלאה, ולכן המוצק שהוסיפו בזמן t1 הוא KOH(s) (הראינו חישובים).
בניסוי זה החומר השני שהוסיפו גם לעליה נוספת ב- pH, ז”א שהוסיפו חומר שיצר בתמיסה יוני הידרוקסיד, (OH)¯(aq), ולכן זהו החומר Ba(OH)2(s).
ואילו החומר השלישי שהוסיפו הוא הסוכר, C6H12O6(s), שלא משנה את ה- pH (הסברנו בסעיף גii).
14. الطاقة والديناميكا المرحلة 1
خليط الغازَيْن هيدروجين، H2(g)، وأوكسجين، O2(g)، يُحفَظ في وعاء زجاجيّ مغلق لمدّة طويلة، بدون تغيير.
عندما يبذلون طاقة بواسطة تفعيل شرارة كهربائيّة في خليط الغازَيْن يحدث التفاعل (1).
(1) H2(g) + 1⁄2O2(g) → H2O(g) ∆Hº1 = − 241.8kJ
- أيّ من القولين A أم B اللذين أمامك يعرض بشكل تخطيطيّ تغيّر الإنتالبيا أثناء التفاعل (1)؟ علّل.

עקומה B מציגה את השתנות האנתלפיה עבור תהליך (1), לתוצרים אנרגיה פנימית נמוכה מהמגיבים. - أيّ من القولين I أم II اللذين أمامك هو القول الصحيح؟
فسّر القول الذي اخترتَه بواسطة نظريّة التصادمات.
- في أعقاب بذل طاقة بواسطة تفعيل شرارة كهربائيّة تقلّ طاقة تنشيط التفاعل (1)، ويحدث التفاعل.
- في أعقاب بذل طاقة بواسطة تفعيل شرارة كهربائيّة تزداد الطاقة الحركيّة لجزيئات الموادّ المتفاعلة في التفاعل (1)، ويحدث التفاعل.
היגד II הוא ההיגד הנכון. כי בהוספת ניצוץ מתווספת אנרגיה למולקולות המגיבים ולכן האנרגיה הקינטית שלהם גדלה, יש יותר התנגשויות ויותר התנגשויות פוריות. ובנוסף לכך, גם האנרגיה הפנימית גדלה וליותר מולקולות יש מספיק אנרגיה כדי ליצור תצמידים משופעלים.
- في التفاعل (2) ينتج من خليط الغازَيْن هيدروجين وأوكسجين، ماء في حالة سائليّة.
(2) H2(g) + 1⁄2O2(g) → H2O(ℓ) ∆Hº2
أمامك ثلاث قيَم لتغيّرات إنتالبيا: -285.9kJ , -241.8kJ , -197.7kJ
حدِّد أيّة قيمة من هذه القيَم تلائم ∆Hº2؟ علّل.
נענה בעזרת גרףהאנרגיה הפנימית של H2O(ℓ)
נמוכה מזו של H2O(g)ולכן, ∆Hº2 = -285.9
أمامك التفاعلان (3) وَ (4):
(3) C3H4(g) +4O2(g) → 3CO2(g) + 2H2O(g) ∆Hº3 = −1848.8kJ
(4) C3H8(g) +5O2(g) → 3CO2(g) + 4H2O(g) ∆Hº3 = − 2043.6kJ
- يتفاعل الهيدروجين مع الپروپين، C3H4(g)، لإنتاج پروپان، C3H8(g)، حسب التفاعل (5)
(5) 2H2(g) + C3H4(g) → C3H8(g) ∆Hº5
ستعن بالتفاعلات الملائمة من بين التفاعلات (1)-(4) واحسب قيمة ∆Hº5.
فصّل حساباتك.ניעזר בחוק הס (תגובה 3 כמו שהיא, תגובה 4 נהפוך, תגובה 1 כפול 2)
(3) C3H4(g) +
4O2(g)→3CO2(g)+2H2O(g)∆Hº3 = − 1848.8kJ
(4)3CO2(g)+4H2O(g)→ C3H8(g) +5O2(g)∆Hº3 = 2043.6kJ
(1) 2H2(g) +O2(g)→2H2O(g)∆Hº1 = − 483.6kJ
————————————————————————————————
2H2(g) + C3H4(g) → C3H8(g) ∆Hº5 = − 288.8kJ - أمامك ثلاثة أقوال III – I
- في التفاعل (5)، الطاقة التي تنطلق أثناء تكوين الأربطة في جزيئات النواتج أصغر من الطاقة التي تُستوعَب أثناء انفصال الأربطة في جزيئات الموادّ المتفاعلة.
- يمكن حساب قيمة ∆Hº5 بواسطة قيَم إنتالبيات الرباط.
- عند إجراء التفاعل (5) في وعاء معزول، ترتفع درجة الحرارة في بيئة الوعاء.
- حدِّد بالنسبة لكلّ واحد من الأقوال III – I إذا كان صحيحًا أم غير صحيح.
היגד I – לא נכון
היגד II – נכון
היגד III – לא נכון (בתוך הכלי עולה מחוץ לכלי לא) - صحِّح كلّ قول غير صحيح.
היגד I – היות והתגובה אקסוטרמית כמות האנרגיה הנפלטת בזמן יצירת הקשרים בתוצרים, גדולה מהאנרגיה הנקלטת בזמן ניתוק הקשרים במגיבים.
היגד III – היות והכלי מבודד, לא עוברת אנרגיה לסביבת הכלי, ולכן סביבת הכלי לא משנה את הטמפרטורה בתוך הכלי (סביבת המערכת), האוויר בכלי יעלה בטמפרטורה.