بچروت في الكيمياء 2018
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان. الفصل الأوّل – إلزاميّ – 40 درجة الفصل الثاني – 60 درجة (3×20 درجة) المجموع – 100 درجة
- موادّ مساعدة يُسمح استعمالها: حاسبة (بما في ذلك الحاسبة البيانيّة).
- تعليمات خاصّة:
- انتبه: في الفصل الأوّل يوجد تسعة أسئلة إلزاميّة. في كلّ واحد من الأسئلة 1-8 معروضة أربع إجابات، عليك أن تختار الإجابة الصحيحة منها. عليك الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19). في السؤال 9 عليكالإجابة عن جميع البنود.
- في الفصل الثاني يوجد خمسة أسئلة. عليك الإجابة عن ثلاثة منها.
التّعليمات في هذا النّموذج مكتوبة بصيغة المذكّر وموجّهة للممتحَنات وللممتحَنين على حدّ سواء.
نتمنّى لك النّجاح!
الأسئلة
الفصل الأوّل (40 درجة)
أجب عن ثمانية الأسئلة 8-1 (لكلّ سؤال – 2.5 درجة).
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختر الإجابة الأكثر ملاءمة.
- أشر إلى الإجابة التي اخترتَها في ورقة الإجابات التي في الغلاف الداخليّ في آخر دفتر الامتحان (صفحة 19).
- في كلّ سؤال، أشر بقلم حبر ب X في المربّع الذي تحت الحرف )أ-د( الذي يدلّ على الإجابة التي اخترتَها.
- في كلّ سؤال يجب الإشارة ب X واحد فقط.
- لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■
- يُمنَع المحو بالتيپكس.
- انتبه: من الجدير الامتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلاً بالإشارة إلى الإجابات الصحيحة في نموذج الامتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- معطى اثنان من نظائر الروبيديوم: وَ .
من بين هذين النظيرين، فقط النظير 87Rb يُطلِق أشعّة ذات نشاط إشعاعيّ.
ما هو التحديد الصحيح؟- عندما يُطلِق النظير أشعّة β ، يَنتُج النظير .
- عدد النيوترونات في النظير 87Rb يساوي عدد النيوترونات في النظير 85Rb.
- عدد الإلكترونات في ذرّة متعادلة لِ 87Rb أكبر من عدد الإلكترونات في ذرّة متعادلة لِ 85Rb.
- المركَّب 87RbCℓ(s) لا يُطلِق أشعّة ذات نشاط إشعاعيّ.
- الحرفان X وَ Z هما رمزان اعتباطيّان يمثّلان عنصرين في الدورة الثالثة )السطر الثالث( في الترتيب الدوريّ.
العنصر X موصِل للكهرباء في الحالة الصلبة.
العنصر Z غير موصِل للكهرباء في الحالة الصلبة.
ما هو القول الصحيح؟- طاقة تأيُّن ذرّة العنصر X أعلى من طاقة تأيُّن ذرّة العنصر Z.
- نصف قطر ذرّة العنصر X أكبر من نصف قطر ذرّة العنصر Z.
- المركَّب الذي يَنتُج من العنصرين X وَ Z هو غاز في درجة حرارة الغرفة.
- صيغة مركَّب العنصر X مع الهيدروجين، H، هي XH4.
- أمامك تمثيل مختصر للصيغتين البنائيّتين لجزيئَي المادّتين: يوريا وأستون.

ما هو القول الصحيح؟- العدد الكلّيّ للإلكترونات في جزيء اليوريا أكبر من العدد الكلّيّ للإلكترونات في جزيء الأستون.
- في جزيئَي المادّتين توجد ذرّات هيدروجين، H ، “مكشوفة من الإلكترونات”.
- بين جزيئات اليوريا وكذلك بين جزيئات الأستون تتكوّن تأثيرات متبادلة من نوع ڤان در ڤالس فقط.
- جزيئات اليوريا وكذلك جزيئات الأستون يمكنها أن تُكوِّن أربطة هيدروجينيّة مع جزيئات الماء.
- حضّروا في المختبر 0.5 لتر محلول، بواسطة إذابة 6.05 غرام نترات الحديد، Fe(NO3)3(s)، في الماء.
الكتلة المولاريّة لِ Fe(NO3)3(s) هي .
ما هو التركيز المولاريّ لأيونات NO‾3(aq) في هذا المحلول؟- 0.025M
- 0.05M
- 0.075M
- 0.15M
- حامض الماليك هو حامض يُكسِب الثمار طعمًا حامضًا بعض الشيء.
أمامك تمثيل مختصر للصيغة البنائيّة لجزيء حامض الماليك: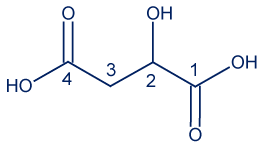 أمامك أربعة أقوال “أ-د” تتعلّق بدرجات تأكسد ذرّات الكربون في جزيء حامضالماليك. ما هو القول الصحيح؟
أمامك أربعة أقوال “أ-د” تتعلّق بدرجات تأكسد ذرّات الكربون في جزيء حامضالماليك. ما هو القول الصحيح؟- درجة تأكسد ذرّة الكربون 1 تختلف عن درجة تأكسد ذرّة الكربون 4.
- درجة تأكسد ذرّة الكربون 2 تساوي درجة تأكسد ذرّة الكربون 3.
- درجة تأكسد ذرّة الكربون 3 هي 2-.
- درجة تأكسد ذرّة الكربون 4 هي 2-.
- الجدول الذي أمامك يعرض معطيات عن أربعة محاليل مائيّة I-IV:
المحلول حجم المحلول
(ملل)تركيز المحلول
(M)I HNO3(aq) 200 0.3 II NaOH(aq) 300 0.2 III CH3OH(aq) 200 0.3 IV Ba(OH)2(aq) 150 0.2 أمامك أربعة تحديدات “أ-د”. ما هو التحديد الصحيح؟
- pH المحلول II يساوي pH של المحلول IV.
- pH المحلول II أعلى من pH المحلول III.
- عندما نُضيف ماءً إلى المحلول I، ينخفض pH المحلول.
- عندما نُضيف ماءً إلى المحلول IV، يرتفع pH المحلول.
- حامض الرومينيك (rumenic acid) هو حامض دهنيّ موجود في حليب الأبقار وفي منتَجاته.
أمامك تمثيل مختصر للصيغة البنائيّة لجزيء حامضالرومينيك: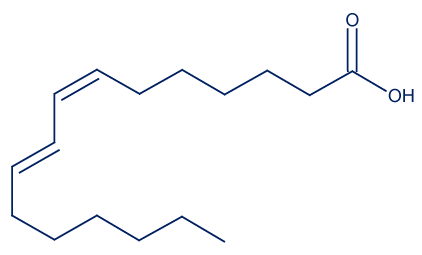 أمامك أربع جمل “أ-د”. ما هي الجملة الصحيحة؟
أمامك أربع جمل “أ-د”. ما هي الجملة الصحيحة؟- الصيغة الجزيئيّة لحامض الرومينيك هي: C17H32O2.
- الكتابة المختصرة لحامض الرومينيك هي: C18:2ω7cis,cis.
- أحد الأربطة المزدوجة في جزيء حامض الرومينيك هو بمبنى ترانس.
- حامض الرومينيك يتبع لمجموعة الأحماض الدهنيّة أوميچا 6.
- معطى التفاعلان (1) وَ (2):
(1) H2(g) + I2(g) → 2HI(g) ΔHº1=-11kJ
(2) H2(g) + Cℓ2(g) → 2HCℓ(g) ΔHº2=?
الجدول الذي أمامك يعرضقيَم إنتالبيا الرباط.
الرباط I–I H–I Cℓ–Cℓ H–Cℓ إنتالبيا الرباط
151 299 242 431 ما هي قيمة ؟
- 184kJ-
- 184kJ+
- 52kJ-
- 52kJ+
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – ه” التي تليها (سؤال إلزاميّ – 20 درجة).
الليثيوم: حلّ لإنتاج جديد للأمونيا
الأمونيا، NH3(g)، هي مادّة حيويّة لإنتاج الأسمدة اللازمة للزراعة الحديثة. يُنتِجون الأمونيا في الوقت الحاضر في الصناعة في تفاعل بين غاز النيتروجين، N2(g), ، الذي في الهواء وبين غاز الهيدروجين، H2(g)، في شروط عالية للضغط ولدرجة الحرارة.
لإنتاج غاز الهيدروجين هناك حاجة لطاقة كبيرة. يحصلون على هذه الطاقة عادةً من عمليّات حرق وقود هيدروكربونيّ، الذي يُعتبر مصدر طاقة فانيًا (متآكلاً). لعمليّات الحرق تأثير سلبيّ على البيئة، لأنّه ينطلق في هذه العمليّات ثاني أكسيد الكربون، CO2(g)، إلى الغلاف الجوّيّ.
لهذا السببيحاول العلماء تطوير عمليّاتبديلة لإنتاج الأمونيا، تُستغَلّ فيها مصادر طاقة متجدّدة (مثل الطاقة الشمسيّة) بدون الإضرار بالبيئة، أي عمليّات مستدامة.
قام علماء من جامعة ستانفورد بتطوير عمليّة دائريّة في المختبر لإنتاج أمونيا في ضغط أتموسفيريّ (جوّيّ). استعملوا
في هذه العمليّة فلزّ (معدن) الليثيوم،Li(s).
مراحل العمليّة معروضة بشكل تخطيطيّ في التخطيط الذي أمامك:

العمليّات التي تحدث في كلّ واحدة من المراحل الثلاث مفصَّلة في الصفحة التالية.
في المرحلة I، يستعملون الطاقة الكهربائيّة، التي يحصلون عليها من مصادر طاقة متجدّدة، لإنتاج الفلزّ Li(s): يصهرون هيدروكسيد الليثيوم، LiOH(s)، ويمرّرون عبره تيّارًا كهربائيًّا. يَنتُج 1 مول من فلزّ الليثيوم، Li(s) من 1 مول LiOH(s).
في المرحلة II، يتفاعل Li(s) مع غاز النيتروجين، N2(g). يَنتُج نتريد الليثيوم، Li3N(s)، حسب التفاعل:
3Li(s) + 1⁄2 N2(g) → Li3N(s)
في المرحلة III، يتفاعل Li3N(s) مع الماء، H2O(ℓ). يَنتُج غاز الأمونيا، NH3(g) وَ LiOH(s)، حسب التفاعل:
Li3N(s) + 3H2O(ℓ) → 3LiOH(s) + NH3(g)
هيدروكسيد الليثيوم الذي نتج في المرحلة III يُعاد إلى بداية العمليّة، أي إلى المرحلة I، لإجراء عمليّة إضافيّة، وهكذا دواليك.
يؤكّد العلماء أنّ الليثيوم حيويّ لهذه العمليّة، لأنّ الليثيوم فقط يتفاعل مع N2(g) في درجة حرارة الغرفة.
العمليّة التي تمّ تطويرها في المختبر لم تُطبَّق حتّى الآن في الصناعة، إ لا لّا لّاأّنّ إمكانيّة إنتاج الأمونيا بطريقة يستعملون فيها مصادر طاقة متجدّدة هي إمكانيّة شيّقة للغاية، ويمكنها أن تُعجِّل تطويرًا صناعيًّا حديثًا.
Jeskins A, “Lithium could hold key to sustainable ammonia synthesis”, Chemistry World :المصدر
- صناعة إنتاج الأمونيا مسؤولة عن %3 بالتقريب من مجمل انطلاق غاز CO2(g) في العالم. اشرح حسب القطعة، لماذا ينطلق CO2(g) في عمليّة إنتاج الأمونيا.
- صف فرقين في المستوى الميكروسكوبيّ بين Li(s) وَ Li3N(s).
- ג
- في المرحلة I من العمليّة الموصوفة في القطعة، يَصهرون LiOH(s). اكتب معادلة عمليّة انصهار LiOH(s).
- حدِّد ما هو نوع التفاعل الذي يحدث في المرحلة II – حامض- قاعدة، أم أكسدة – اختزال، أم ترسيب. علّل تحديدك.
- حدِّد إذا كان الماء في المرحلة III: مُذيبًا أم مختزِلاً أم حامضًا أم قاعدةً. علّل تحديدك.
- حسب التفاعلات التي في المراحل الثلاث للعمليّة الموصوفة في القطعة، يمكن الحصول من 3 مول LiOH(s) على 1 مول NH3(g). لكن عمليًّا، بهذه الطريقة، يمكن إنتاج أكثر من 1 مول NH3(g) من 3 مول LiOH(s). فسّر لماذا.
- بهدف ملاءَمة العمليّة التي تمّ تطويرها في المختبر لعمليّة صناعيّة لإنتاج الأمونيا، هناك حاجة لموارد كثيرة. اكتب حجاجًا )ادّعاءً معلَّلاً( واحدًا يؤيّد جدارة إنتاج الأمونيا بالطريقة الجديدة المعروضة في القطعة. علّل.
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 10 – 14 (لكلّ سؤال – 20 درجة).10. المبنى والترابط وكيمياء الغذاء
زيت جوز الهند هو زيت نباتيّ يُنتَج من ثمرة شجرة جوز الهند.- معظم الزيوت النباتيّة (مثل زيت الزيتون، زيت الذُّرَة) هي سوائل في درجة حرارة الغرفة، بينما زيت جوز الهند هو صلب في درجة حرارة الغرفة.
القولان b ، a اللذان أمامك يتعلّقان بعوامل يمكنها أن تؤثّر على حالة المادّة (الحالة التراكميّة للمادّة) لزيت
جوز الهند في درجة حرارة الغرفة.
حدِّد أيّ قول، a أم b، هو الصحيح. فسّر لماذا دحضتَ القول الآخر.
- في التريچليسيريدات التي في زيت جوز الهند توجد نسبة مئويّة عالية لأحماضدهنيّة مشبعة.
- في التريچليسيريدات التي في زيت جوز الهند توجد نسبة مئويّة عالية لأحماضدهنيّة غير مشبعة من نوع ترانس.
- زيت جوز الهند الذي مرّ بهدرجة (הידרוגנציה) يُستعمَل بديلاً للدهن في صناعة الغذاء.
- ما هي عمليّة الهدرجة؟
- حدِّد إذا كانت درجة حرارة انصهار زيت جوز الهند الذي مرّ بهدرجة أعلى من درجة حرارة انصهار زيت جوز الهند الطبيعيّ (الذي لم يمرّ بهدرجة) أم أقلّ منها. علّل تحديدك.
- تريليورين هو تريچليسيريد موجود في زيت جوز الهند.
أمامك تمثيل مختصر للصيغة البنائيّة للتريليورين:
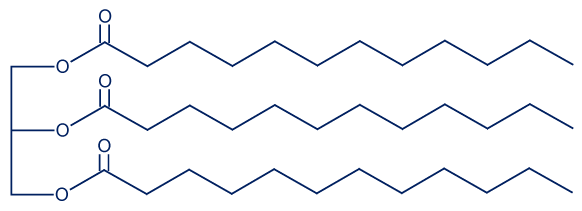 في حلمأة التريليورين يحصلون على حامضاللاوريك (lauric acid) وناتج إضافيّ.
في حلمأة التريليورين يحصلون على حامضاللاوريك (lauric acid) وناتج إضافيّ.
- اكتب كتابة مختصرة لحامضاللاوريك.
- اكتب تمثيلاً كاملاً للصيغة البنائيّة للناتج الإضافيّ الذي يَنتُج في تفاعل حلمأة التريليورين.
- ذائبيّة حامضاللاوريك في الماء منخفضة. فسّر لماذا.
- يُستعمَل حامضاللاوريك أيضًا لإنتاج الصابون لاورات الصوديوم، CH3(CH2)10COONa(s).
- يَنتُج لاورات الصوديوم في تفاعل حامضاللاوريك مع مادّة إضافيّة. حدِّد أيّة مادّة – NaOH(aq) أم NaCℓ(aq) – تلائم التفاعل مع حامضاللاوريك لإنتاج الصابون. علّل تحديدك.
- توجد بين جسيمات لاورات الصوديوم أربطة أيونيّة وكذلك تأثيرات متبادلة من نوع ڤان در ڤالس. فسّر هذا التحديد.
11. الحسابات الكيميائيّة وحالة الغاز
يتناول السؤال غاز أكسيد النتروز، N2O(g)، الذي يُسمّى “غاز الضحك”.- في وعاء مغلق A حجمه 1 لتر يوجد 4.4 غرام N2O(g).
في وعاء مغلق B حجمه 2 لتر يوجد 6.4 غرام أوكسجين، O2(g).
الوعاءان موجودان في درجة حرارة متشابهة.
أمامك قولان I وَ II.
حدِّد أيّ قول من القولين، I أم II، هو القول الصحيح. علّل تحديدك.
- ضغط الغاز في الوعاء A هو ضعف ضغط الغاز في الوعاء B.
- ضغط الغاز في الوعاء A يساوي ضغط الغاز في الوعاء B.
- في درجات حرارة أعلى من 577°C, N2O(g) إلى عنصرَيْه، النيتروجين والأوكسجين.
- اكتب معادلة موازَنة لتفاعل تحلُّل N2O(g) إلى عنصرَيْه.
- أجروا تجربة. أدخلوا N2O(g). إلى وعاء مغلق يحوي هواءً. سخّنوا الوعاء حتّى درجة حرارة 600°C، خلال t دقائق، إلى أن توقّف ضغط الغازات في الوعاء عن التغيّر.
أيّ رسم بيانيّ من الرسوم البيانيّة III–I التي أمامك يصف بصورة صحيحة تغيُّر عدد مولات O2(g) داخل الوعاء؟ علّل.

- يستعملون N2O(g) بِدَمْج مع O2(g)، في علاج الأسنان (خاصّةً لدى الأطفال) من أجل تقليصالإحساس
بالألم ومستوى القلق والخوف.
يَستنشق المعالَج خليطًا للغازَيْن من داخل كمّامة موضوعة على أنفه.
في 100 ملل من خليط الغازَيْن في شروط الغرفة يوجد 30 ملل N2O(g) وَ 70 ملل O2(g).
في كلّ نَفَس يَستنشق المعالَج 500 ملل من خليط الغازَيْن.
احسب عدد جزيئات N2O(g) التي يَستنشقها المعالَج في كلّ نَفَس.
فصّل حساباتك.
معطى أنّ:
- حجم 1 مول غاز في شروط الغرفة هو 25 لترًا.
- في 1 مول جسيمات يوجد 6.02×1023 جسيم.
- ד
- يخزنون أكسيد النتروز في ضغط عالٍ، في الحالة السائلة، في أوعية خاصّة. وعاء معدّ للاستعمال في عيادة أسنان يحوي 2.92 كغم N2O(ℓ). ماذا كان حجم هذه الكتلة من N2O(g) אلو خزنوه في شروط الغرفة؟ فصّل حساباتك. معطى أنّ: حجم 1 مول غاز في شروط الغرفة هو 25 لترًا.
- في الصناعة، يُنتِجون الغاز N2O(g) بواسطة تسخين نترات الأمونيوم، NH4NO3(s)، حسب التفاعل:
NH4NO3(s) → N2O(g) + H2O(ℓ)
احسب كتلة NH4NO3(s) اللازمة لإنتاج 2.92 كغم من أكسيد النتروز. فصّل حساباتك.
12. الأكسدة – الاختزال والحسابات الكيميائيّة
يتناول السؤال عنصر الكلور، Cℓ2(g)، وبعضمركَّباته.- الكلور هو أحد الموادّ المتفاعِلة في كلّ واحد من التفاعلات( 1)-( 3) التي أمامك:
(1) Cℓ2(g) + 2Na(s) → 2NaCℓ(s)
(2) Cℓ2(g) + F2(g) → 2CℓF(g)
(3) Cℓ2(g) + 2H2O(ℓ) → 2HCℓO(aq) + H3O+(aq) + Cℓ‾(aq)
- بالنسبة لكلّ واحد من التفاعلين ( 1) وَ ( 2)، حدِّد هل Cℓ2(g) هو المؤكسِد أم المختزِل. علّل.
- في التفاعل (3) توجد ذرّات كلور في ثلاثة أنواع جسيمات. حدِّد درجة تأكسد ذرّات الكلور في كلّ واحد من الجسيمات.
- بالنسبة للتفاعل (3)، حدِّد هل Cℓ2(g) מيتفاعل كمؤكسِد فقط، أم كمختزِل فقط، أم كمؤكسِد وكمختزِل أيضًا.
- ב
- عندما يَدفِقون غاز كلور، Cℓ2(g)، إلى وعاء يحوي رقيقة ألومنيوم، Aℓ(s)، يحدث تفاعل. اكتب معادلة موازَنة للتفاعل بين Cℓ2(g) وَ Aℓ(s).
- كم مول إلكترونات مرّت في التفاعل الذي تفَاعَلَ فيه 4.05 غرام Aℓ(s) مع كمّيّة ملائمة من Cℓ2(g)؟ فصّل حساباتك.
- خليط من فوق كلورات الأمونيوم، NH4CℓO4(s) وَ Aℓ(s)، يُستعمَل وقودًا صلبًا لتحريك الصواريخ التي تحمل السفن الفضائيّة.
هاتان المادّتان يمكنهما أن تتفاعلا حسب التفاعل (4) الذي أمامك.
(4) 3NH4CℓO4(s) + 3Aℓ(s) → Aℓ2O3(s) + AℓCℓ3(s) + 6H2O(g) + 3NO(g)
في جهاز تجريبيّ، تفاعلت عيّنة من 0.6 مول NH4CℓO4(s) مع كمّيّة ملائمة من Aℓ(s) حسب التفاعل (4). احسب الحجم الكلّيّ للغازات، الذي نتج في هذا التفاعل. فصّل حساباتك. معطى أنّ: حجم 1 مول غاز في شروط التجربة هو 35 لترًا. - كلورات البوتاسيوم، KCℓO3(g)، يُستعمَل، من ضمن استعمالات أخرى، مصدرًا لِ O2(g) في المختبرات. في شروط ملائمة، يتحلّل KCℓO3(g) إلى O2(g) وإلى ناتج إضافيّ. حدِّد ما هي صيغة الناتج الإضافيّ – KCℓ أم KCℓO4. علّل تحديدك.
- محلول هيپوكلوريت الصوديوم، NaCℓO(aq)، الذي يُسمّى “إكونوميكا” يُستعمَل للتعقيم وللتنظيف. في 100 ملل من محلول إكونوميكا أُذيبت 3 غرام NaCℓO(s). احسب التركيز المولاريّ لأيونات CℓO‾(aq) في هذا المحلول. فصّل حساباتك.
13. חומצות ובסיסים וסטוכיומטריה
حامضالكبريتيك، H2SO4(ℓ)، هو مادّة خامة هامّة في الصناعة الكيميائيّة. عندما يخلطون محلول H2SO4(aq) مع محلول هيدروكسيد الكالسيوم، Ca(OH)2(aq), ، تَرْسُبُ مادّة صلبة بيضاء. هذه المادّة الصلبة هي كبريتات الكالسيوم، Ca2SO4(s) (“جبس”). أمامك معادلة التفاعل:Ca2+(aq) + 2OH‾(aq) + 2H3O+(aq) + SO2-4(aq) → CaSO4(s) + 4H2O(ℓ)
أجرى بعضالطُلَّاب تجربة. إلى وعاء حوى 20 ملل من محلول H2SO4(aq) بتركيز 0.25M أضافوا بالتدريج 100 ملل من محلول Ca(OH)2(aq)، وقاسوا التوصيل الكهربائيّ للمحلول. الرسم البيانيّ الذي أمامك يعرضبشكل تخطيطيّ التغيّر في التوصيل الكهربائيّ للمحلول خلال التجربة.
- א
- فسّر لماذا التوصيل الكهربائيّ للمحلول في النقطة B قابل للإهمال.
- احسب التركيز المولاريّ لمحلول Ca(OH)2(aq) الذي استعملوه في التجربة. فصّل حساباتك.
- قاس الطُلَّاب خلال التجربة pH المحلول أيضًا.
- وُجد أنّ pH المحلول في النقطة A التي في الرسم البيانيّ المعطى هو أقلّ من pH المحلول في النقطة B. فسّر هذه النتيجة.
- وُجد أنّ pH المحلول في النقطة C التي في الرسم البيانيّ المعطى هو أعلى من pH المحلول في النقطة B. فسّر هذه النتيجة.
- في تجربة أخرى، خلطوا 200 ملل من محلول H2SO4(aq) بتركيز 0.25M مع 300 ملل من محلول هيدروكسيد البوتاسيوم، KOH(aq)، بتركيز 0.3M . في التفاعل الذي حدث نتج سائل صافٍ (لم يَنتُج راسب).
- اكتب معادلة صافية للتفاعل الذي حدث.
- حدِّد إذا كان pH المحلول في نهاية التفاعل حامضيًّا أم قاعديًّا أم متعادلاً. فصّل حساباتك.
- احسب التركيز المولاريّ لأيونات K+(aq) في المحلول الصافي الذي نتج. فصّل حساباتك.
14. الطاقة ووتيرة التفاعل
قام العلماء وطُلَّاب الكيمياء على مرّ السنين ببحث احتراق الشمعة. المركَّب الأساسيّ الذي يُركِّب شَمْع الشمعة هو هيدروكربون صيغته الجزيئيّة هي: C25H52. وُجد أنّه أثناء احتراق فتيلة الشمعة تحدث عدّة عمليّات: ينصهر الشمع، ويُمتَصّفي الفتيلة، ويتحوّل إلى غاز، ويتفاعل بتفاعل احتراق مع الأوكسجين، O2(g)، الذي في الهواء.- اكتب معادلة موازَنة لتفاعل الاحتراق الكامل لِ C25H52(g).
- ב
- ما هي مجموعة التجربة في التجربة الموصوفة؟
- حدِّد إذا كان القول الذي أمامك صحيحًا أم غير صحيح. علّل تحديدك. احتراق فتيلة الشمعة يُزوِّد فقط طاقة التنشيط اللازمة لتفاعل احتراق C25H52(g).
- بعد أن احترقت الشمعة لمدّة 10 دقائق، أطفأ الطُلَّاب الشمعة وَوَزَنُوها. وُجد أنّ كتلة الشمعة انخفضت بِ 1 غرام. وفقًا للحساب، وُجد أنّ كمّيّة الطاقة التي انطلقت في تفاعل احتراق 1 غرام C25H52(g) تساوي 34kJ. احسب التغيّر في الإنتالبيا المعياريّة، ΔH0، في تفاعل احتراق 1 مول C25H52(g). فصّل حساباتك.
- ד
- إنتالبيا التبخير للهيدروكربون C25H52(ℓ) هي: . احسب قيمة ΔHº بالنسبة لتفاعل الاحتراق الكامل لِ 1 مول C25H52(ℓ). فصّل حساباتك.
- أمامك مخطّط طاقة.
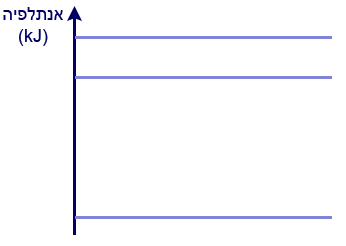 انسخ المخطّط إلى دفترك، وأشر فيه إلى مكان الموادّ المتفاعِلة والنواتج لتفاعلَي الاحتراق:
تفاعل الاحتراق الكامل لِ C25H52(g) وتفاعل الاحتراق الكامل لِ C25H52(ℓ).
أشر في المخطّط الذي في دفترك إلى قيَم ΔHº الملائمة.
انسخ المخطّط إلى دفترك، وأشر فيه إلى مكان الموادّ المتفاعِلة والنواتج لتفاعلَي الاحتراق:
تفاعل الاحتراق الكامل لِ C25H52(g) وتفاعل الاحتراق الكامل لِ C25H52(ℓ).
أشر في المخطّط الذي في دفترك إلى قيَم ΔHº الملائمة.
- استُعملت الشموع المحترقة في الماضي أجهزة لقياس الزمن أيضًا.
لهذا الغرضأشاروا بجانب الشمعة إلى سلسلة خطوط بفوارق متساوية (انظر الرسم التوضيحيّ). أمامك أربعة أقوال (1)-(4). اذكر ما هي الأقوال التي تميّز احتراق الشمعة كجهاز لقياس الزمن. (1) وتيرة احتراق الشمعة هي ثابتة. (2) التغيّر في كتلة الشمعة في وحدة زمن هو ثابت. (3) كمّيّة الطاقة التي تنطلق في وحدة زمن من احتراق الشمعة هي ثابتة. (4) درجة حرارة لهبة الشمعة ترتفع بشكل ثابت.