امتحان بجروت في الكيمياء 2022
امتحان بجروت في الكيمياء 2022
تعليمات
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان. الفص ل الأوّل – 40 درجة الفصل الثاني – 60 درجة المجموع – 100 درجة
- موادّ مساعدة يُسمح استعمالها:
- حاسبة (بما في ذلك الحاسبة البيانيّة).
- ملحق قوانين ومعطيات (مُرفق).
- تعليمات خاصّة:
- في الفصل الأوّل يوجد تسعة أسئلة. في كلّ واحد من الأسئلة 1-8 معروضة أربع إجابات، يجب اختيار الإجابة الصحيحة. يجب الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19). في السؤال 9 يجب الإجابة عن البنود حسب التعليمات.
- في الفصل الثاني يوجد خمسة أسئلة. يجب الإجابة عن ثلاثة منها.
يجب الكتابة في دفتر الامتحان فقط. يجب كتابة “مسوّدة” في بداية كلّ صفحة تُستعمَل مسوّدة. كتابة أيّة مسوّدة على أوراق خارج دفتر الامتحان قد تسبّب إلغاء الامتحان.
الأسئلة في هذا النّموذج ترد بصيغة الجمع، ورغم ذلك يجب على كلّ طالبة وطالب الإجابة عنها بشكل فرديّ.نتمنّى لكم النّجاح !
الأسئلة
الفصل الأوّل (40 ةجرد)
أجيبوا عن جميع الأسئلة 1 – 8.
إذا أجبتم صحيحًا عن ستّة أسئلة على الأقلّ، ستحصلون على ال 20 درجة بأكملها (لكلّ سؤال – 31/3 درجات).
قبل أن تجيبوا، اقرأوا جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختاروا الإجابة الصحيحة.
* أَشيروا إلى الإجابة التي اخترتموها في ورقة الإجابات التي في الغلاف الداخليّ في آخر دفتر الامتحان (صفحة 19).
* في كلّ سؤال، أشيروا بقلم حبر ﺒِ X في المربّع الذي تحت الحرف (أ–د) الذي يدلّ على الإجابة التي اخترتموها.
* في كلّ سؤال يجب الإشارة ﺒِ X واحد فقط.
* لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■.
* يُمنَع المحو بالتيپكس.
* انتبهوا: يُحبَّذ ا امتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلًا بالإشارة إلى الإجابات الصحيحة في نموذج ا امتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- معطى اثنان من نظائر الصوديوم: 22Na وَ 23Na.
ما هو القول الصحيح؟- الشحنة النوويّة للنظير 23Na أكبر من الشحنة النوويّة للنظير 22Na.
- عدد النيوترونات في النظير 22Na أصغر من عدد النيوترونات في النظير 23Na.
- عدد الإلكترونات في النظير 23Na أكبر من عدد الإلكترونات في النظير 22Na.
- عدد الپروتونات في النظير 22Na أصغر من عدد الپروتونات في النظير 23Na.
- أمامكم صِيَغ تمثيل إلكترونيّة I-V:
I II III IV V 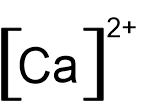

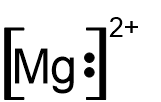
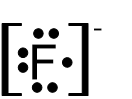
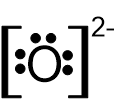
أيّة صيغتين من الصِّيَغ V–I تمثّلان بشكل صحيح أيونات أحاديّة الذرّات؟
- I وَ II
- III وَ IV
- III وَ V
- IV وَ V
- أمامكم جدول فيه معطيات عن مادّتين:
اسم المادّة درجة حرارة الغليان
(C°)تمثيل كامل للصيغة البنائيّة لجزيء المادّة 1-پنتانول 138 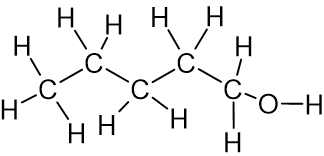
1-أمينو پنتان 104 
درجة حرارة غليان 1-أمينو پنتان أقلّ من درجة حرارة غليان 1-پنتانول.
ما هو سبب ذلك؟- مساحة السطح الخارجيّ لجزيء 1-أمينو پنتان أصغر من مساحة السطح الخارجيّ لجزيء 1-پنتانول.
- السحابة الإلكترونيّة في جزيء 1-أمينو پنتان أصغر من السحابة الإلكترونيّة في جزيء 1-پنتانول.
- الأربطة الهيدروجينيّة التي تتكوّن بين جزيئات 1-أمينو پنتان أضعف من الأربطة الهيدروجينيّة التي تتكوّن بين جزيئات 1-پنتانول.
- يوجد في جزيء 1-أمينو پنتان عدد أقلّ من المراكز الممكنة لتكوين أربطة هيدروجينيّة ممّا في جزيء 1-پنتانول.
- سَخَّنوا 1.125 غرام من المادّة الصلبة نترات النحاس Cu(NO3)2(s) ().
خلال التسخين، حدث التفاعل:
تفاعلت كلّ كمّيّة نترات النحاس.
ما هو القول الصحيح الذي يتطرّق إلى نواتج التفاعل؟- نتج 0.38 غرام من المادّة الصلبة CuO(s) ().
- نتج 0.006 مول من NO2(g).
- نتج 0.048 مول من جزيئات الأوكسجين.
- نتج في التفاعل ما مجموعه 0.015 مول من الغازات.
- أُجريت تجربة وُضِع فيها وعاءان على ميزان: الوعاء A والوعاء B.
في الوعاء A كان محلول نترات فضّة، AgNO3(aq)، وفي الوعاء B كان محلول كلوريد صوديوم، NaCℓ(aq).
الكتلة الكلّيّة للموادّ وللوعاءين، التي قيست بالميزان كانت 16.0 غرام (انظروا الرسم التوضيحيّ I).
سكبوا كلّ المحلول الذي كان في الوعاء B إلى المحلول الذي في الوعاء A ، ووضعوا على الميزان الوعاء B الفارغ والوعاء A الذي حدث فيه التفاعل (انظروا الرسمين التوضيحيّين II ו- III).
معادلة التفاعل هي:Ag+(aq) + NO3–(aq) + Na+(aq) +Cℓ–(aq) → AgCℓ(s) + Na+(aq) + NO3–(aq)
أمامكم الرسوم التوضيحيّة III–I، التي تصف المراحل الثلاث في التجربة.

ما هي الكتلة الكلّيّة التي قيست بالميزان في نهاية التفاعل (الرسم التوضيحيّ III)؟- كتلة أكبر من 16.0 غرام.
- كتلة أصغر من 16.0 غرام.
- كتلة تساوي 16.0 غرام.
- لا يمكن تحديد الكتلة الكلّيّة بدون معطيات عن تركيز المحلولين وحجمهما.
- أذابوا 2.96 غرام من نترات المغنيسيوم، Mg(NO3)2(s)، داخل 100 ملل من محلول نترات الصوديوم، NaNO3(aq)، الذي تركيزه 0.1M.
معطاة الكتلة المولاريّة لنترات المغنيسيوم: .ما هو تركيز أيونات NO3–(aq) في المحلول بعد الإذابة؟
- 0.5M
- 0.4M
- 0.3M
- 0.2M
- أمامكم قيمتا ΔH0 لتفاعلَي الحرق (1) ו- (2):
(1) N2(g) + 2O2(g) →2NO2(g) ΔH01 = +66.4kJ
(2) 2NO(g) + O2(g) → 2NO2(g) ΔH02 = -114.4kJأمامكم التفاعل 3
(3) N2(g) + O2(g) →2NO(g) ΔH03 =?
ما هي قيمة ΔH03 للتفاعل (3)؟
- 180.8kJ-
- 180.8kJ+
- 48.0kJ-
- 48.0kJ+
- في تجربة معيّنة، خلطوا غازَيْن: أمونيا، NH3(g)، وكلوريد الهيدروجين،, HCℓ(g). حدث تفاعل.
الناتج الذي حصلوا عليه هو المادّة الصلبة الأيونيّة كلوريد الأمونيوم، NH4Cℓ(s).
معادلة التفاعل الذي حدث هي:NH3(g) + HCℓ(g) → NH4Cℓ(s)
ما هو التحديد الصحيح؟
- الأمونيا، NH3(g)، في هذا التفاعل هي المؤكسِد.
- الأمونيا، NH3(g)، في هذا التفاعل هي القاعدة.
- كلوريد الهيدروجين، HCℓ(g)، في هذا التفاعل هو المؤكسِد.
- كلوريد الهيدروجين، HCℓ(g)، في هذا التفاعل هو القاعدة.
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأوا القطعة التي أمامكم، وأجيبوا عن البنود التي تليها حسب التعليمات (سؤال إلزاميّ – 20 درجة).
الهيدروجين – أحد حلول الوقود المستقبليّ
يعتقد معظم العلماء أنّ هناك علاقة بين ارتفاع درجة حرارة الغلاف الجوّيّ في القرن الحالي، احترار الأرض، وبين حرق كمّيّات كبيرة من الوقود الذي يحوي في الأساس مركَّبات كربون (وقود أحفوريّ).
يؤدّي حرق هذا الوقود إلى انطلاق طاقة متوافرة للاستعمال. ينطلق في عمليّة الحرق إلى الغلاف الجوّيّ ثاني أكسيد الكربون، CO2(g)، الذي يُعتبر غاز احتباس حراريّ (غاز دفيئة). غازات الاحتباس الحراريّ تلتقط أشعّة تنعكس من سطح الكرة الأرضيّة، ولذلك تؤدّي إلى تسخّنها (ارتفاع درجة حرارتها).
في المؤتمرات المناخيّة التي تُنظِّمها الأمم المتّحدة، يناقشممثِّلو الدول إمكانيّة تقليصانطلاق ثاني أكسيد الكربون حتّى عام 2050، بهدف إبطاء احترار الأرض. إحدى الإمكانيّات التي تمّ نقاشها هي توليد الطاقة بواسطة حرق )تفاعل مع الأوكسجين، (O2(g))، غاز الهيدروجين، H2(g)، من حرق الوقود الذي يحوي مركَّبات كربون.
الهيدروجين لا يظهر كعنصر على سطح الكرة الأرضيّة، لذلكهناك حاجة لإنتاجه من مركَّبات مختلفة بواسطة عمليّات كيميائيّة تتطلّب بذل طاقة.
من المعتاد تسمية الهيدروجين المُنتَج حسب طريقة الإنتاج، مثلًا:
“الهيدروجين الرماديّ“: أرخص هيدروجين، ويُنتَج من ضمن موادّ أخرى، من الغاز الطبيعيّ. المركِّب الأساسيّ في الغاز الطبيعيّ هو الميثان، CH4(g). عندما يتفاعل الميثان مع بخار الماء، H2O(g)، في ضغط عالٍ، ينتج الغازان ثاني أكسيد الكربون، CO2(g)، الذي ينطلق إلى الغلافالجوّيّ، والهيدروجين، H2(g)، الذي يُجمَع في حاويات تخزين.
“الهيدروجين الأزرق“: هيدروجين يُنتَج في عمليّة مشابهة لعمليّة إنتاج “الهيدروجين الرماديّ”، لكن غاز CO2(g) الذي ينتج في العمليّة، لا ينطلق إلى الغلاف الجوّيّ، وإنّما يُجمَع هو أيضًا خلال الإنتاح. هناك تكنولوجيّات مختلفة لجمع واستغلال CO2(g) موجودة في مرحلة التطوير.
إحدى المشاكل في عمليّة إنتاج “الهيدروجين الرماديّ” وَ”الهيدروجين الأزرق” هي أنّ الميثان، CH4(g)، الذي يُعتبر هو أيضًا غاز احتباس حراريّ، يمكن أن ينطلق إلى الغلاف الجوّيّ.
“الهيدروجين الأخضر“: هيدروجين يُنتَج في عمليّة تحليل الماء بمساعدة الكهرباء في شروط ملائمة. ناتجا التحليل هما هيدروجين وأوكسجين فقط. تحتاج هذه العمليّة إلى بذل طاقة تنتج من استغلال مصادر طاقة متجدّدة كالشمس والرياح.
يمكن استعمال الهيدروجين كوقود بحيث يكون حرق الهيدروجين مصدرًا للطاقة في الصناعة وفي تشغيل المَرْكَبات الكبيرة.
استعمال الهيدروجين كوقود مستقبليّ يسُببِّ عدةّ مشاكل:
- الهيدروجين الذي ينُتجَ في حالة مادةّ يجب تخزينه في حاويات كبيرة مقُاومِة للضغط العالي.
- تخزين الهيدروجين في حالة مادةّ سائليةّ يحُتمِّ تبريده حتىّ درجة حرارة منخفضة جداًّ (20.3K)، التي يتحولّ فيها إلى سائل.
- أثناء حرق الهيدروجين في الهواء يحدث تفاعل إضافيّ بين الأوكسجين، O2(g)، والنيتروجين، N2(g)، الذي في الهواء. في هذا التفاعل ينتج ثاني أكسيد النيتروجين، NO2(g), الذي يعُتبر هو أيضاً غاز احتباس حراريّ غير مرغوب فيه.
يمكن استعمال الهيدروجين كوقود في السياّرات المركبَّ فيها مركبِّ خاص.ّ يحدث في هذا المركبِّ تفاعل أكسدة اختزال بين غاز الهيدروجين وغاز الأوكسجين الذي مصدره من الهواء. يحدث هذا التفاعل على السطح الخارجيّ لمحفزِّ صلب.
صناعة السياّرات التي تحُركَّ بالهيدروجين تتطورّ في أنحاء العالم، وتنُشأَ محطاّت للتزودّ السريع بغاز الهيدروجين.
السياّرات التي تحُركَّ بالهيدروجين يمكنها أن تنافس السياّرات الكهربائيةّ التي تعمل ببطاّرياّت تشُحَن وتحتاج إلى وقت طويل للشحن.
في الوقت الحاضر، جزء صغير جداًّ فقط من استهلاك الطاقة العالميّ يعتمد على الهيدروجين. ربمّا تقوم ًلامستقبلََا دول أخرى باستعمال الهيدروجين مصدرََا للطاقة.
المصدر:
Dewan Angela (2021). Green hydrogen could be the fuel of the future. Here’s why it’s not yet a silver bullet. CNN, August 31.
- هل حرق الوقود الذي يحوي مركَّبات كربون هو تفاعل إندوثيرميّ؟ علِّلوا حسب القطعة.
- ما هو الناتج الممكن في حرق الهيدروجين: ثاني أكسيد الكربون أم أوّل أكسيد الكربون أم الماء؟ علِّلوا اختياركم.
- اكتبوا معادلة موازَنة لعمليّة إنتاج غاز “الهيدروجين الرماديّ”.
- حدِّدوا المؤكسِد والمختزِل في التفاعل الذي كتبتم معادلته في البند “ج”. علِّلوا تحديدكم.
- حدِّدوا إشارة ΔH0 للتفاعل الذي يحدث أثناء إنتاج “الهيدروجين الأخضر”. علِّلوا حسب القطعة.
- أمامكم رسمان بيانيّان: I وَ II. حدِّدوا ما هو الرسم البيانيّ الذي يصف بشكل صحيح تأثير المحفِّز على التفاعل الذي يحدث في المركِّب المركَّب في السيّارات التي تُحرَّك بالهيدروجين. علِّلوا تحديدكم.

| يجب اختيار أحد البندين “ز” أو “ﺤ”. |
- في عمليّة إنتاج “الهيدروجين الأزرق” تَفاعَلَ 1 طنّ من الميثان، CH4(g). في هذه العمليّة، جمعوا ثاني أكسيد الكربون، CO2(g)، الذي نتج. هل كتلة ثاني أكسيد الكربون الذي نتج في التفاعل هي أكبر من 1 طنّ أم أصغر من 1 طنّ؟ فصِّلوا حساباتكم أو علِّلوا كلاميًّا. معطى أنّ: 1 طنّ = 106×1 غرام.
- حسب القطعة، يُغيِّر الهيدروجين حالة المادّة من غاز إلى سائل في درجة حرارة 20.3K في ضغط أتموسفيريّ. هل درجة حرارة غليان الأوكسجين في نفس الشروط هي أعلى من 20.3K أم أقلّ من 20.3K؟ علِّلوا إجابتكم. تطرّقوا إلى القوى التي تعمل بين جزيئات كلّ واحد من العنصرين في حالة المادّة السائليّة.
الفصل الثاني (60 درجة)
أجيبوا عن ثلاثة من الأسئلة 14-10 (لكلّ سؤال 20 درجة).
10. المبنى والترابط، الحسابات، الطاقة
يتناول السؤال موادّ تُسمّى معيقات اشتعال.
مطافئ الحريق التي تُستعمَل في المنازل تحوي غازات أو مساحيق أو رغوة تعيق الاشتعال.
استعمَلوا في الماضي غازًا صيغته CBrF3(g).
في الوقت الحاضر، يَستبدِل هذا الغاز خليطٌ من ثلاثة غازات: Ar(g), CF4(g), CHCℓ2CF3(g).
- اكتبوا صِيَغ تمثيل إلكترونيّة للجزيئات: CHCℓ2CF3(g) وَ CBrF3(g) وَ CF4(g).
أمامكم جدول يعرضدرجتَي حرارة غليان مادّتين وشكلَ جزيءِ كلّ واحدة منهما:
| المادّة (في درجة حرارة الغرفة) | درجة حرارة الغليان (C°) | شكل جزيء المادّة |
| CBrF3(g) | -58 | رباعيّ السطوح |
| CF4(g) | -128 | رباعيّ السطوح |
- اذكروا عاملين للفرق بين درجتَي حرارة غليان المادّتين.
- فسِّروا كيف يؤثّر كلّ واحد من العاملين اللذين ذكرتموهما في البند”ب” على قوّة القوى التي تعمل بين الجزيئات.
المساحيق التي تُستعمَل لإطفاء الحرائق الكبيرة هي في الأساس هيدروكسيد الألومنيوم، Aℓ(OH)3(s)، וوهيدروكسيد المغنيسيوم، Mg(OH)2(s). تقوم الطائرات بنثر هذه المساحيق من الجوّ على مكان الحريق مع مادّة لونها أحمر.
المركَّب Aℓ(OH)3(s) يتحلّل في درجات حرارة عالية إلى المادّة الصلبة أكسيد الألومينيوم، Aℓ2O3(s)، وبخار ماء.
المركَّب Mg(OH)2(s) يتحلّل في درجات حرارة عالية إلى المادّة الصلبة أكسيد المغنيسيوم، MgO(s)، وبخار ماء.
- اكتبوا معادلة موازَنة لتفاعل تحلُّل Aℓ(OH)3(s).
- اكتبوا معادلة موازَنة لتفاعل تحلُّل Mg(OH)2(s).
- في التجربة 1 سَخَّنوا 3.9 غرام Aℓ(OH)3(s). تحلّلت كلّ المادّة.
ما هو عدد مولات بخار الماء الذي نتج في التفاعل؟ فصِّلوا حساباتكم. - في التجربة 2 سَخَّنوا كتلة معطاة من Mg(OH)2(s). تحلّلت كلّ المادّة. عدد مولات بخار الماء الذي نتج في التفاعل كان مطابقًا لعدد مولات بخار الماء الذي حسبتموه في البند “و”.
هل عدد مولات Mg(OH)2(s) الذي تحلّل في التجربة 2 مطابق لعدد مولات Aℓ(OH)3(s) الذي تحلّل في التجربة 1؟ فصِّلوا حساباتكم أو علِّلوا كلاميًّا. - تفاعُلا تحلُّل Aℓ(OH)3(s) وَ Mg(OH)2(s) يساهمان في خَفْضدرجة حرارة البيئة في منطقة الاشتعال. هل تفاعُلا التحلّل هما إندوثيرميّان أم إكسوثيرميّان؟ فسِّروا إجابتكم.
11. المبنى والترابط، الطاقة
يتناول السؤال المادّتين: إيثانول، C2H5OH(ℓ)، وكلوريد البوتاسيوم، KCℓ(s).
أمامكم ستّة رسوم توضيحيّة، 1-6، تصف بصورة جزئيّة مباني ميكروسكوبيّة مختلفة:

- حدِّدوا ما هو الرسم التوضيحيّ الذي يصف المبنى الميكروسكوبيّ لِ C2H5OH(ℓ) في درجة حرارة الغرفة، وحدِّدوا ما هو الرسم التوضيحيّ الذي يصف المبنى الميكروسكوبيّ لِ KCℓ(s) في درجة حرارة الغرفة.
إلى وعاء معيّن فيه ماء أضافوا كلوريد البوتاسيوم، وإلى وعاء آخر فيه ماء أضافوا إيثانو لا لًا. المادّتان تذوبان جيّدًا في الماء.
من إذابة KCℓ(s) نتج المحلول 1، ومن إذابة C2H5OH(ℓ) نتج المحلول 2.
- اكتبوا معادلة عمليّة إذابة KCℓ(s) في الماء.
- اكتبوا معادلة عمليّة إذابة C2H5OH(ℓ) في الماء.
- أيّ من المحلولين، المحلول 1 أم المحلول 2، موصِل للكهرباء؟ فسِّروا لماذا المحلول الذي اخترتموه موصِل للكهرباء.
أُجرِيَت تجربة أذابوا فيها 0.2 مول KCℓ(s) في 200 ملل من الماء في وعاء غير معزول. قبل الإذابة قيست درجة حرارة ابتدائيّة للماء وكانت 22°C.
أمامكم الرسم البيانيّ 1 الذي يصف تغيُّر درجة حرارة الماء أثناء الإذابة وبعدها.

أمامكم مخطّطان للطاقة، a وَ b.

- أيّ من المخطّطين، a أم b , يصف بشكل صحيح تغيُّر الطاقة في عمليّة إذابة KCℓ(s) في الماء؟
علِّلوا اختياركم واعتمِدوا فيه على الرسم البيانيّ 1.
سكبوا المادّة سيكلوهكسان، C6H12(l)، إلى وعاءين: إلى أحد الوعاءين أضافوا KCℓ(s)، وإلى الوعاء الآخر أضافوا C2H5OH(ℓ).
خلطوا الموادّ في كلّ واحد من الوعاءين.
إحدى المادّتين فقط ذابت في السيكلوهكسان. نتج محلول غير موصِل للكهرباء.
- أيّة مادّة من المادّتين ذابت؟ علِّلوا لماذا.
- اكتبوا معادلة عمليّة الإذابة في السيكلوهكسان.
12. الأحماض الدهنيّة
أمامكم جدول يعرضعدّة أحماضدهنيّة:
| الحامض الدهنيّ | الرمز | تمثيل مختصر للصيغة البنائيّة لجزيء المادّة | درجة حرارة ا انصهار (C°) |
| حامض البوتيريك | B |  | -5.7 |
| حامض الكپريليك | Oc | 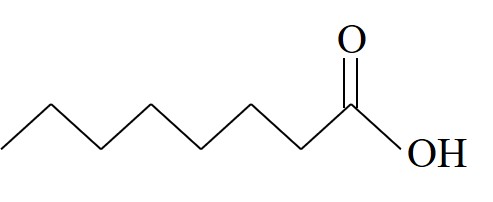 | 16.3 |
| حامض اللوريك | La | 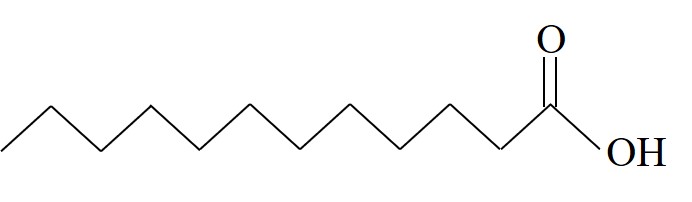 | 43.8 |
| حامض الستاريك | S | 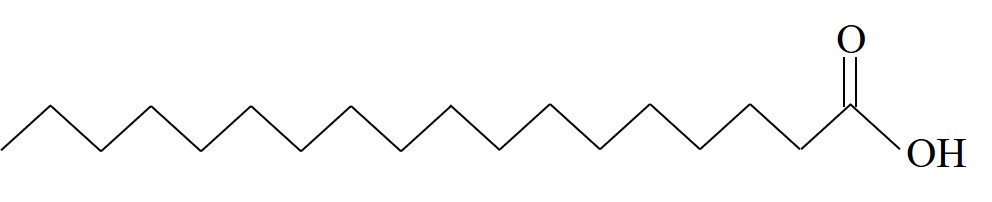 | 69.3 |
| حامض اللينولييك | L |  | -5.9 |
- اكتبوا كتابة مختصرة لكلّ واحد من الأحماضالدهنيّة المعروضة في الجدول.
- ما هو العامل لذلك بأنّ درجة حرارة انصهار حامضاللينولييك (L) أقلّ من درجة حرارة انصهار حامض الستاريك (S)؟
حامضالكپريك، الذي رمزه D، هو حامضدهنيّ مشبع يحوي 10 ذرّات كربون.
- اكتبوا لامًختصرًا للصيغة البنائيّة لجزيء حامضالكپريك.
- استعينوا بالمعطيات التي في الجدول، وحدِّدوا إذا كانت درجة حرارة انصهار حامضالكپريك هي 4°C أم 31.6°C.
اذكروا العامل الذي اعتمدتم عليه في إجابتكم. - عندما يضيفون هيدروجينًا، H2(g)، إلى حامضاللينولييك بوجود محفِّز ملائم، يحصلون على حامضالستاريك.
كم مول هيدروجين، H2(g)، يلزم لتفاعل كامل مع 1 مول من حامضاللينولييك؟ فسِّروا إجابتكم. - زيت جوز الهند غنيّ بالتريچليسيريدات المركَّبة من أحماضدهنيّة مشبعة، التي لديها سلاسل ذرّات كربون طولها متوسّط.
مث لا لًا، التريچليسيريد OcLaD، الذي ينتج من الچليسيرول وحامضالكپريليك وحامضاللوريك وحامض الكپريك.
أمامكم تمثيل مختصر للصيغة البنائيّة لجزيء چليسيرول: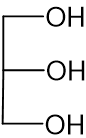 أيّ تمثيل مختصر من بين ثلاثة الجزيئات (1) – (3) التي أمامكم يصف بشكل صحيح الصيغة البنائيّة لجزيء التريچليسيريد OcLaD؟
أيّ تمثيل مختصر من بين ثلاثة الجزيئات (1) – (3) التي أمامكم يصف بشكل صحيح الصيغة البنائيّة لجزيء التريچليسيريد OcLaD؟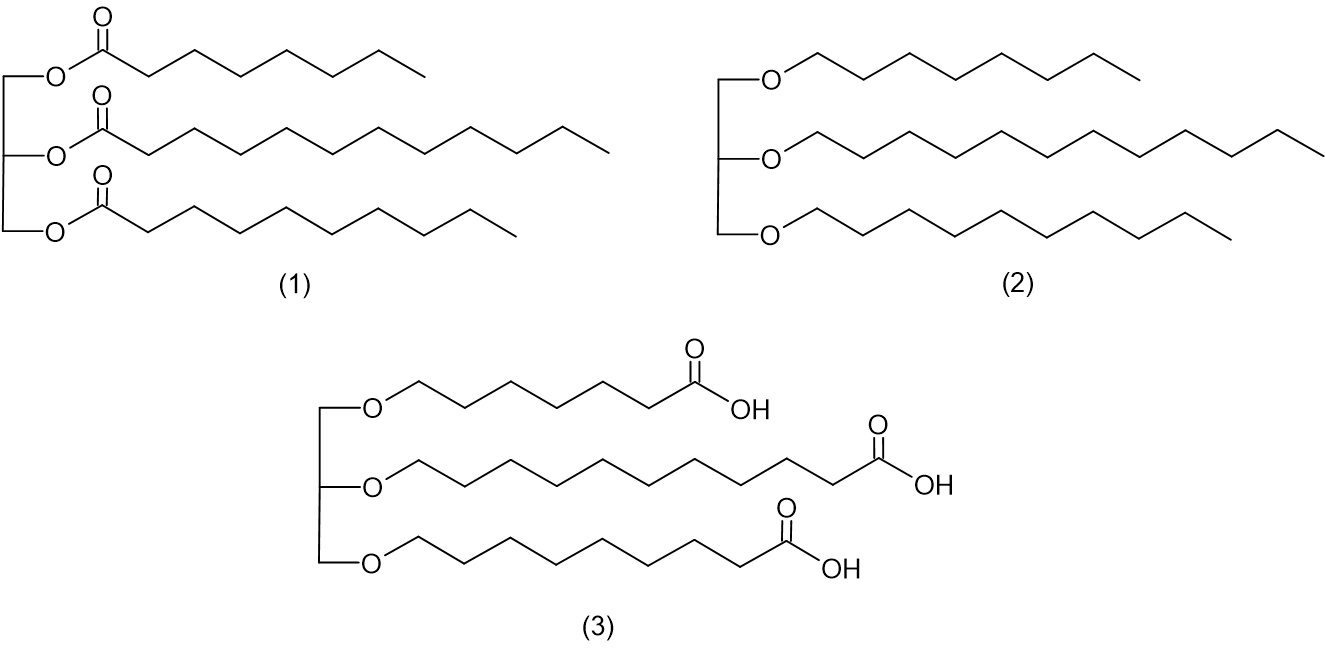
- العشب الطازج يحوي، من ضمن موادّ أخرى، بيتا -كروتين، الذي لونه أصفر – برتقاليّ.
أمامكم تمثيل مختصر للصيغة البنائيّة لجزيء بيتا-كروتين: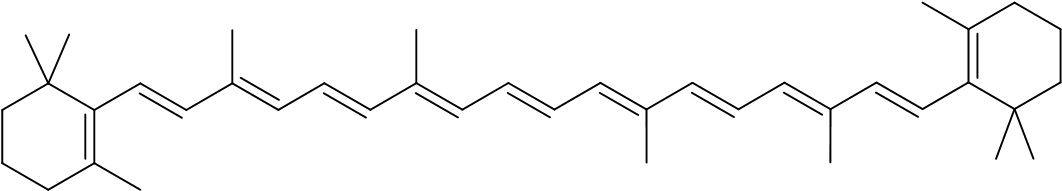
الزبدة، التي تُنتَج من حليب البقرات التي تتغذّى من العشب الطازج، لونها أصفر بسبب المادّة بيتا-كروتين الموجودة في حليب هذه البقرات. تحوي الزبدة حوالي %81 دهنيّات، وحوالي %18 ماء وموادّ أخرى.
حدِّدوا إذا كان بيتا-كروتين يذوب في الدهنيّات أم في الماء الذي في الزبدة. تطرّقوا في إجابتكم إلى القوى التي تعمل بين الجزيئات.
13. الأكسدة – ا اختزال، الحسابات
يتناول السؤال تجربتين.
التجربة 1:
معطاة ثلاثة أنابيب اختباريّة 1– 3:
الأنابيب لاختباريّ 1 يحوي محلول أيونات كلور Cℓ–(aq) وأيونات صوديوم Na+(aq).
الأنابيب لاختباريّ 2 يحوي محلول أيونات بروم Br–(aq) وأيونات صوديوم Na+(aq).
الأنابيب لاختباريّ 3 يحوي محلول أيونات يود I–(aq) وأيونات صوديوم Na+(aq).
إلى كلّ واحد من الأنابيب الاختباريّة أضافوا محلول Cℓ2(aq).
أمامكم رسمان توضيحيّان يصفان الأنابيب الاختباريّة 1-3 قبل إضافة محلول Cℓ2(aq) وبعدها:

- حسب الرسم التوضيحيّ 2، صِفوا مشاهَدة واحدة لكلّ واحد من الأنابيب الاختباريّة بعد إضافة محلول Cℓ2(aq).
حدثت في التجربة تفاعلات فقط في اثنين من ثلاثة الأنابيب الاختباريّة.
أمامكم معادلتان صافيتان للتفاعلين اللذين حدثا أثناء التجربة:
Cℓ2(aq) +2I–(aq) → I2(aq) + 2Cℓ–(aq) : I التفاعل
Cℓ2(aq) +2Br–(aq) → Br2(aq) + 2Cℓ–(aq) : II التفاعل
- حدِّدوا درجات تأكسد كلّ واحد من الجسيمات التي تشارك في التفاعلين.
- أمامكم قولان، ( 1) وَ ( 2)، يتطرّقان إلى التفاعلين اللذين حدثا. حدِّدوا بالنسبة لكلّ قول إذا كان صحيحًا أم غير صحيح. علِّلوا كلّ واحد من التحديدين.
(1) في التفاعلين I وَ II المؤكسِد هو Cℓ2(aq).
(2) في التفاعلين I وَ II المختزِل هو Cℓ–(aq).
في نهاية التفاعل، حجم المحلول في الأنبوب الاختباريّ الذي حدث فيه التفاعل II كان 5 ملل.
تركيز أيونات الكلور Cℓ–(aq) في نهاية التفاعل كان 0.1M.
- ما هو عدد جزيئات البروم، Br2(aq)، التي نتجت في التفاعل؟ فصِّلوا حساباتكم.
נمعطى أنّه: في 1 مول يوجد 1023×6.02 جسيم.
التجربة 2:
أشعلوا صوف حديد، مركَّب في الأساس من حديد صلب، Fe(s).
في التفاعل، يتفاعل Fe(s) مع الأوكسجين الذي في الهواء، O2(s)، وينتج المركَّب الأيونيّ الصلب أكسيد الحديد.
ذرّات الحديد تُنتِج نوعين من الأيونات: Fe2+ وَ Fe3+، لذلك يوجد مركَّبان ممكنان لأكسيد الحديد، كلّ واحد منهما يلائم أحد هذين الأيونَيْن.
- اكتبوا صيغتَي المركَّبين الممكنين لأكسيد الحديد في درجة حرارة الغرفة.
في التجربة الموصوفة، نتجت المادّة الصلبة الأيونيّة التي فيها أيون الحديد هو Fe3+.
- اكتبوا معادلة موازَنة للتفاعل الذي حدث في التجربة.
- هل التفاعل الذي كتبتم معادلته هو تفاعل أكسدة – اختزال؟
إذا كان كذلك، حدِّدوا ما هو المؤكسِد وما هو المختزِل. إذا لم يكن كذلك، علِّلوا إجابتكم. - في التجربة، تفاعل 9.8 غرام من صوف الحديد، Fe(s)، مع الأوكسجين، O2(g)، حسب التفاعل الذي كتبتم معادلته في البند “و”.
ما هي كتلة أكسيد الحديد التي نتجت في التفاعل؟ فصِّلوا حساباتكم.
14. الحوامض والقواعد
الجدول الذي أمامكم يعرضمعطيات عن أربعة محاليل مائيّة ( 1)–( 4). جميع المحاليل عديمة اللون.
| المحلول | صيغة المادّة التي أُدخلت إلى الماء | حجم المحلول (ملل) | تركيز المحلول (M) |
| (1) | KOH(s) | 100 | 1 |
| (2) | Ba(OH)2(s) | 100 | 1 |
| (3) | HCℓ(g) | 100 | 1 |
| (4) | H2SO4(ℓ) | 100 | 1 |
- اكتبوا معادلة العمليّة التي تحدث عندما يُدخِلون كلّ واحدة من الموادّ المعروضة في الجدول إلى الماء:
KOH(s) , Ba(OH)2(s) , HCℓ(g) , H2SO4(ℓ) - درِّجوا المحاليل (1) –(4) حسب ال pH من المنخفضإلى العالي.
- أضافوا 100 ملل من الماء المقطّر إلى كلّ واحد من المحاليل.
حدِّدوا بالنسبة لكلّ واحد من القولين II–I إذا كان صحيحًا أم غير صحيح. علِّلوا كلّ تحديد.- تركيز المحاليل تَغيَّر.
- تدريج المحاليل حسب ال pH تَغيَّر.
أمامكم جدول يعرضمعطيات عن لون ثلاثة كواشف في قيَم مختلفة لل pH .
ألوان الكواشف في قيَم مختلفة لل pH
| الكاشف | pH 14 | pH 12 | pH 10 | pH 7 | pH 4 | pH 2 | pH 0 |
| ماء الملفوف | أصفر | أخضر | أخضر | أزرق | ورديّ | أحمر | أحمر |
| فينول فتالين | ورديّ | ورديّ | ورديّ | عديم اللون | عديم اللون | عديم اللون | عديم اللون |
| مثيل برتقاليّ | أصفر | أصفر | أصفر | أصفر | برتقاليّ | أحمر | أحمر |
- اعتمِدوا على المعطيات، وحدِّدوا بالنسبة لكلّ واحد من الأقوال iii-i إذا كان صحيحًا أم غير صحيح. علِّلوا كلّ تحديد.
- فينول فتالين هو كاشف يُمكِّن الكشف عن المحاليل القاعديّة من بين المحاليل (1) – (4).
- يمكن التمييز بين المحلول (2) والمحلول (3) بمساعدة الكاشف ماء الملفوف.
- يمكن التمييز بين المحلول (1) والمحلول (2) بمساعدة الكاشف مثيل برتقاليّ.
خلطوا المحاليل فيما بينها حسب الموصوف في الجدول الذي أمامكم. حدث تفاعل في كلّ خلط.
معطى أنّ: جميع مركَّبات البوتاسيوم (K) هي موادّ سهلة الذوبان، بينما كبريتيد الباريوم، BaSO4(s)، هو مادّة بيضاء عسيرة (صعبة) الذوبان.
- أجيبوا بالنسبة لكلّ واحدة من التجارب IV-I التي أمامكم:
- ما هو مجال pH المحلول بعد الخلط؟
- هل المحلول بعد الخلط موصِل للكهرباء؟
| رقم التجربة | المحلولان اللذان خُلِطا | مشاهَدات للمحلول بعد الخلط | مجال pH المحلول بعد الخلط (حامضيّ أم قاعديّ أم متعادل) | التوصيل الكهربائيّ للمحلول بعد الخلط (موصِل للكهرباء أم غير موصِل للكهرباء) |
| I | (1) وَ (3) | المحلول صافٍ | ||
| II | (1) وَ (4) | المحلول صافٍ | ||
| II | (2) وَ (3) | المحلول صافٍ | ||
| IV | (2) وَ (4) | نتج راسب أبيض |
- في التجارب III-I حدثت تفاعلات لديها نفس المعادلة الصافية. اكتبوا هذه المعادلة.
- اختاروا من بين المعادلات (1)-(3)، ما هي المعادلة التي تلائم التفاعل الذي حدث في التجربة IV.
(1) Ba2+(aq) + 2OH–(aq) + 2H3O+(aq) + SO42-(aq)→ Ba2+(aq) + SO42-(aq) + 2H2O(ℓ)
(2) Ba(OH)2(aq) + H2SO4(ℓ) → BaSO4(s) + 2H2O(ℓ)
(3) Ba2+(aq) + 2OH–(aq) + 2H3O+(aq) + SO42-(aq) → BaSO4(s) + 4H2O(ℓ)