امتحان بجروت في الكيمياء 2019
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان.
الفصل الأوّل – إلزاميّ – 40 درجة
الفصل الثاني – 60 درجة (3×20 درجة)
المجموع – 100 درجة - موادّ مساعدة يُسمح استعمالها: حاسبة (بما في ذلك الحاسبة البيانيّة).
- تعليمات خاصّة:
- انتبه: في الفصل الأوّل يوجد تسعة أسئلة إلزاميّة.
في كلّ واحد من الأسئلة 1-8 معروضة أربع إجابات، عليك أن تختار الإجابة الصحيحة منها. عليك الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
في السؤال 9 عليكالإجابة عن جميع البنود. - في الفصل الثاني يوجد خمسة أسئلة. عليك الإجابة عن ثلاثة منها.
- انتبه: في الفصل الأوّل يوجد تسعة أسئلة إلزاميّة.
التّعليمات في هذا النّموذج مكتوبة بصيغة المذكّر وموجّهة للممتحَنات وللممتحَنين على حدّ سواء.
نتمنّى لك النّجاح!
الأسئلة
الفصل الأوّل (40 درجة)
أجب عن ثمانية الأسئلة 8-1 (لكلّ سؤال 2.5 درجة).
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختر الإجابة الصحيحة.
- أشر إلى الإجابة التي اخترتَها في ورقة الإجابات التي في الغلاف الداخليّ في آخر دفتر الامتحان (صفحة 19).
- في كلّ سؤال، أشر بقلم حبر بِ X في المربّع الذي تحت الحرف )أ-د( الذي يدلّ على الإجابة التي اخترتَها.
- في كلّ سؤال يجب الإشارة بِ X واحد فقط.
- لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■.
- يُمنَع المحو بالتيپكس.
- انتبه: من الجدير الامتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلاً بالإشارة إلى الإجابات الصحيحة في نموذج الامتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- الجدول الذي أمامك يعرضمعطيات عن تركيبة ثلاثة جسيمات أُشير إليها اعتباطيًّا بالأحرف X وَ Y وَ Z.
الجسيم عدد الپروتونات عدد النيوترونات تنظُّم الإلكترونات X 8 10 2 , 8 Y 9 10 2 , 8 Z 8 8 2 , 6 ما هو التحديد الصحيح؟
- الجسيمان X وَ Y هما نظيران لنفس العنصر.
- للجسيمان X وَ Z نفس الشحنة النوويّة.
- ثلاثة الجسيمات X وَ Y وَ Z هي أيونات سالبة.
- الجسيم Y يمثّل ذرّة نيون، Ne.
- الصوديوم، Na(s)، يتفاعل مع الفوسفور، P4(s).
ما هي الصيغة الأمپيريّة للمركَّب الذي يَنتُج في هذا التفاعل؟- NaP4
- NaP3
- Na3P
- Na4P
- معطاة ثلاث موادّ في الحالة السائلة.
CH3CH2F(ℓ) , CH3CH2OH(ℓ) , CH3CH2NH2(ℓ)
أمامك أربعة أقوال “أ – د” تتعلّق بالقوى التي تعمل بين جزيئات هذه الموادّ.
ما هو القول الصحيح؟- في كلّ واحدة من الموادّ الثلاث توجد أربطة هيدروجينيّة بين الجزيئات.
- الأربطة الهيدروجينيّة التي بين جزيئات CH3CH2NH2(ℓ) أقوى من الأربطة الهيدروجينيّة التي بين جزيئات CH3CH2F(ℓ).
- الأربطة التي بين جزيئات CH3CH2F(ℓ) أقوى من الأربطة التي بين جزيئات CH3CH2OH(ℓ).
- بين جزيئات CH3CH2F(ℓ) توجد تأثيرات متبادلة ڤان در ڤالس فقط.
- معطى الوعاءان، A وَ B ، حجم كلّ واحد منهما هو 1 لتر.
الوعاء A مليء بغاز الميثان، CH4(g).
الوعاء B مليء بغاز الأوكسجين، O2(g).
درجة الحرارة والضغط متساويان في الوعاءين.
ما هو التحديد الصحيح؟- عدد مولات الغاز في الوعاء A يساوي عدد مولات الغاز في الوعاء B.
- عدد جزيئات الغاز في الوعاء B ضعف عدد جزيئات الغاز في الوعاء A.
- كتلة الغاز في الوعاء A تساوي كتلة الغاز في الوعاء B.
- كتلة الغاز في الوعاء A ضعف كتلة الغاز في الوعاء B.
- أمامك معادلة تفاعل أكسدة – اختزال.
4NH3ׂ(g) + 6NO(g) → 5N2(g) + 6H2O(g)
ما هو التحديد الصحيح؟
- الغاز NO(g) هو المختزِل.
- تمرّ الإلكترونات من ذرّات N في جزيئات NO إلى ذرّات N في جزيئات NH3.
- عندما يتفاعل 1 مول NH3ׂ(g)، تمرّ 3 مول إلكترونات.
- N2(g) هو ناتج اختزال NH3ׂ(g).
- أمامك معادلات لثلاثة تفاعلات (1)-(3).
1. K2O(s) + H2O(ℓ) → 2K+(aq) + 2OH–(aq)
2. K(s) + H2O(ℓ) → 2K+(aq) + 1⁄2H2(g) + 2OH–(aq)
2. KHSO4(s) + H2O(ℓ) → 2K+(aq) + SO2-4(aq) + H3O+(aq)في أيّ تفاعل/تفاعلين يتفاعل الماء، H2O(ℓ)، كقاعدة؟
- في التفاعل (1) فقط.
- في التفاعل (2) فقط.
- في التفاعل (1) وكذلك في التفاعل (2).
- في التفاعل (3) فقط.
- أمامك مخطّط لتغيّرا ت إنتالبيا.
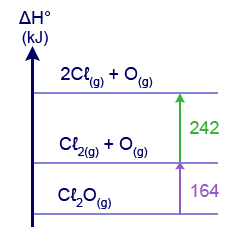 מהו הערך של אנתלפיית הקשר O–Cℓ בתרכובת Cℓ2O(g)?
מהו הערך של אנתלפיית הקשר O–Cℓ בתרכובת Cℓ2O(g)?- 406kJ⁄moℓ
- 203kJ⁄moℓ
- 164kJ⁄moℓ
- 82kJ⁄moℓ
- عندما يخلطون محلولاً لحامضكلوريد الهيدروجين، HCℓ(aq)، مع محلول ثيوكبريتات الصوديوم، Na2S2O3(aq)، يحدث تفاعل.
أمامك معادلة صافية لهذا التفاعل:2H3O+(aq) + S2O32-(aq) → 3H2O(ℓ) + SO2(g) +1⁄8S8(s)
بحث بعضالط الطُلَّاب التفاعل واقترحوا مقاييس مختلفة لوتيرة التفاعل.
أمامك أربعة اقتراحات IV-I اقترحها الط الطُلَّاب للحصول على معلومات عن وتيرة التفاعل.
I. قياس التوصيل الكهربائيّ للمحلول في نهاية التفاعل.
II. قياس pH المحلول في نهاية التفاعل.
III. قياس التوصيل الكهربائيّ للمحلول في فوارق زمنيّة ثابتة.
IV. قياس pH المحلول في فوارق زمنيّة ثابتة.
ما هما الاقتراحان الأكثر ملاءمة؟- I وَ II
- I وَ IV
- II وَ III
- III وَ IV
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – د” التي تليها (سؤال إلزاميّ – 20 درجة).
ثاني أكسيد الكربون: من ناتج غير مرغوب فيه إلى مادّة خامة مستقبليّة
يؤدّي احترار الأرض)ارتفاع درجة الحرارة العالميّة( إلى تغييرات مناخيّة، وهو أحد المشاكل التي تواجهها البشريّة في القرن الحاليّ. أحد عوامل احترار الأرض هو ارتفاع تركيز غاز ثاني أكسيد الكربون، CO2(g)، في الغلاف الجوّيّ، الذي يساهم في ارتفاع معدّل درجات الحرارة على سطح الكرة الأرضيّة. ارتفاع تركيز CO2(g) في الغلاف الجوّيّ هو من ضمن نتائج أخرى، نتيجة حرق الفحم، C(s)، بكمّيّات متزايدة واستعمال الوقود الهيدروكربونيّ لتزويد الطاقة.
يُطالَب العلماء وأرباب الصناعة والحكومات بإيجاد حلول من أجل تقليصكمّيّة CO2(g) التي تنطلق إلى الغلاف الجوّيّ.
أحد الحلول، الذي يُطبَّق في الوقت الحاضر، هو استعمال مصادر طاقة متجدِّدة (كالشمس والرياح) بدلاً من استعمال الفحم والوقود الهيدروكربونيّ.
يُدرَس في السنوات الأخيرة توجّه ثوريّ ورياديّ لا يَعتبر CO2(g) ناتجًا غير مرغوب فيه، وإنّما يَعتبره مادّة خامة ومصدرًا لذرّات الكربون في الصناعة الكيماويّة. الهدف هو استيعاب CO2(g) الذي ينطلق في عمليّات الحرق، خاصّةً في محطّات توليد الكهرباء، واستغلاله لإنتاج مركَّبات كربون متنوّعة تُنتَج اليوم من مركَّبات النفط الخام الآخذ في الفناء.
التخطيط 1 يعرضجزءًا من مركَّبات الكربون التي يمكن إنتاجها من CO2(g):

من هذه المركَّبات، يمكن إنتاج موادّ كثيرة تُستعمَل وقودًا أو موادّ خامة في الصناعة الكيماويّة.
استغلال CO2(g) كمادّة خامة يتطلّب مواجهة صعوبتين أساسيّتين:
- فصل CO2(g) عن الغازات الأخرى التي تنطلق من مداخن محطّات توليد الكهرباء.
- بذل طاقة كبيرة تلزم خلال إنتاج هذه المركَّبات.
إيجاد حلول لهاتين الصعوبتين يشكّل تحدّيًا أمام علماء الكيمياء والعلماء الآخرين.
ا لمصدر: Clarke J. (2017), “Carbon dioxide can be a Versatikix feedstock for a variety of undustries” , Chemistry World
- السولار هو وقود هيدروكربونيّ يُستعمَل في محطّات توليد الكهرباء.
الهيدروكربون C12H26(ℓ) هو أحد مركِّبات السولار.
- حسب القطعة، حدِّد هل تفاعل إنتاج CO2(g) من وقود هيدروكربونيّ هو إكسوثيرميّ أم إندوثيرميّ. علّل.
- اكتب معادلة موازَنة للتفاعل الذي يَنتُج فيه CO2(g) من الهيدروكربون C12H26(ℓ).
- ב
- اختر أربعة من المركَّبات التي يمكن إنتاجها من CO2(g)، المعروضة في التخطيط 1.
انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
اسم المركَّب صيغة المجموعة الوظيفيّة اسم المجموعة الوظيفيّة 1 2 3 4 - التخطيط 1 يعرضثلاثة مركَّبات هي في حالة سائلة في درجة حرارة الغرفة. أحد هذه المركَّبات الثلاثة هو حامضالفورميك. درجة حرارة غليان حامضالفورميك أعلى من درجة حرارة غليان المركَّبين الآخرين. فسّر هذه الحقيقة. تطرّق في إجابتك إلى القوى التي تعمل بين الجزيئات في كلّ واحد من المركَّبات الثلاثة.
- اختر أربعة من المركَّبات التي يمكن إنتاجها من CO2(g)، المعروضة في التخطيط 1.
انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
- ג
- لإنتاج الميثانول، CH3OH(ℓ)، من CO2(g) هناك حاجة لمادّة إضافيّة. حدِّد هل المادّة الإضافيّة في هذا التفاعل تَتَفاعل كمُؤكسِد أم كمُختزِل. علّل.
- يحدث هذا التفاعل على سطح محفِّز خاصّمركَّب من معدنَي الپالاديوم، Pd(s)، والنحاس، Cu(s)، في درجة حرارة بين 180°C وَ 250°C. קوتيرة التفاعل هي أسرع بوجود المحفِّز. فسّر هذه الحقيقة بمساعدة نظريّة التصادمات.
- حسب القطعة، اذكر إيجابيّتين لاستغلال CO2(g) الذي ينطلق إلى الغلاف الجوّيّ من أجل إنتاج مركَّبات كربون متنوّعة.
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 14-10 (لكلّ سؤال 20 درجة).10. مبنى الذرّة، الدوريّة، المبنى والترابط
الهاتف الذكيّ يحوي موادّ فيها أكثر من 70 عنصرًا: فلزّات ولافلزّات وعناصر شائعة وعناصر نادرة.- المركِّبات الأساسيّة في زجاج شاشة الهاتف الذكيّ هي: ثاني أكسيد السيليكون، SiO2(s)، وأكسيد الصوديوم، Na2O(s) ، وأكسيد الألومنيوم، Aℓ2O3(s).
- انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
SiO2(s) Aℓ2O3(s) نوع الجسيمات في المادّة نوع الأربطة بين الجسيمات - اكتب صِيَغ تمثيل إلكترونيّة للجسيمات التي يتركّب منها المركَّب Na2O(s).
- من أجل تقوية زجاج الشاشة، يستبدلون قسمًا من أيونات الصوديوم بأيونات أكبر. لهذا الغرضيغمسون زجاج الشاشة في مركَّب أيونيّ منصهر ملائم. حدِّد أيّ مركَّب يلائم هذه العمليّة: نترات الليثيوم، LiNO3(ℓ)، أم نترات البوتاسيوم، KNO3(ℓ). علّل تحديدك.
- انسخ الجدول الذي أمامك إلى دفتر الامتحان، وأكمله.
- شاشة اللَّمس، الموجودة تحت الزجاج، مبنيّة من طبقة شفّافة من أكسيد الإينديوم، In2O3(s) وموادّ إضافيّة. النظير الشائع للإينديوم هو . ما هو عدد الپروتونات وعدد النيوترونات وعدد الإلكترونات في جسيمات الإينديوم في المركَّب 115In2O3(s)؟
- الرقاقة (الشريحة) الإلكترونيّة مبنيّة من سيليكون، Si(s)، بإضافة ذرّات عناصر مثل: الفوسفور، 15P، أو الچاليوم، 31Ga، أو الأرسين، 33As.
- طاقة التأيّن الأولى للسيليكون، Si، هي 789kJ⁄moℓ. طاقة التأيّن الأولى للفوسفور، P، هي 1012kJ⁄moℓ. فسّر لماذا طاقة التأيّن الأولى للفوسفور، P، أعلى من طاقة التأيّن الأولى للسيليكون، Si.
- أمامك قيمتان لطاقتَي تأيّن 947kJ⁄moℓ وَ 1251kJ⁄moℓ. ما هي القيمة التي تلائم طاقة التأيّن الأولى للأرسين، As؟ علّل.
- بطّاريّة الهواتف الذكيّة تحوي، من ضمن موادّ أخرى، چرافيت، C(s).
- اكتب ثلاثة مميّزات للمبنى الميكروسكوبيّ للچرافيت.
- الچرافيت موصِل للتيّار الكهربائيّ. فسّر لماذا.
11. كيمياء الغذاء والطاقة
الزبدة هي منتَج غنيّ بالدهن، تُنتَج من الحليب أو من الشَّمِينِتْ في عمليّة تُسمّى مَخْضًا.- يُزوِّد الدهن %99.4 من القيمة الكالوريّة (السعريّة) للزبدة.. القيمة الكالوريّة لِ 100 غرام زبدة هي 733 كيلو – كالوري. معطى أنّ: القيمة الكالوريّة لِ 1 غرام دهن هي 9 كيلو – كالوري. احسب كم غرام دهن يوجد في 100 غرام زبدة. فصّل حساباتك.
| الحامض الدهنيّ | الرمز | كتابة مختصرة للحامض الدهنيّ | النسبة المئويّة |
| حامضالميريستيك | M | C14:0 | 12% |
| حامضالپلاميتيك | P | C16:0 | 26% |
| حامضالستاريك | S | C18:0 | 11% |
| حامضالأولييك | O | C18:1ω9 , cis | 28% |
- عندما نُخرِج الزبدة من الث لا لاجة، فإنّها تَطْرى في درجة حرارة الغرفة ويمكن دهنها بسهولة. أمامك قائمة لتريچليسيريدات موجودة في الزبدة: MOO , SPS , SPM , MPO , SPP , POO ثلاثة من التريچليسيريدات التي في القائمة تجعل الزبدة تَطْرى في درجة حرارة الغرفة. حدِّد ما هي هذه التريچليسيريدات الثلاثة. فسّر لماذا تجعل هذه التريچليسيريدات الزبدة تَطْرى.
- حامضالبوتيريك، C4:0، هو مركِّب نسبته المئويّة قليلة في تريچليسيريدات الزبدة.
عندما تتلف الزبدة، بسبب حلمأة هذه التريچليسيريدات، يَنتُج حامضالبوتيريك الذي ينشر رائحة كريهة.
- التريچليسيريد SPB هو أحد التريچليسيريدات المركَّب من حامضالبوتيريك أيضًا.
الحرف B هو رمز حامضالبوتيريك.
اكتب تمثيلاً مختصرًا للصيغة البنائيّة للتريچليسيريد SPB.
معطى التمثيل المختصر للصيغة البنائيّة لجزيء چليسيرول:
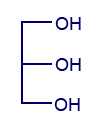
- التأثيرات المتبادلة التي بين جزيئات التريچليسيريد SPB أضعف من التأثيرات المتبادلة التي بين جزيئات التريچليسيريد SPP. اذكر ما هو سبب ذلك.
- التريچليسيريد SPB هو أحد التريچليسيريدات المركَّب من حامضالبوتيريك أيضًا.
الحرف B هو رمز حامضالبوتيريك.
اكتب تمثيلاً مختصرًا للصيغة البنائيّة للتريچليسيريد SPB.
معطى التمثيل المختصر للصيغة البنائيّة لجزيء چليسيرول:
- الأحماضالدهنيّة، التي على شكل تريچليسيريدات، تُخزَن في الجسم في خلايا دهنيّة وتُستعمَل، من ضمن בין استعمالات أخرى، مصدرًا للطاقة.
تمرّ الأحماضالدهنيّة التي في الخلايا بسلسلة عمليّات يَنتُج فيها ثاني أكسيد الكربون، CO2(g)، وماء، H2O(ℓ)، كما يحدث في تفاعل الحرق الكامل لمركَّبات الكربون.
التفاعل (1) الذي أمامك هو تفاعل حرق حامضالبوتيريك:
(1) C3H7COOH(ℓ) + 5O2(g) → 4CO2(g) + 4H2O(ℓ) ΔH0(1)=?
معطاة ثلاثة تفاعلات، I-III:I. C(s) + O2(g) → CO2(g) ΔH0(I)=-393.5kJ II. H2(g) + 1⁄2O2(g) → H2O(ℓ) ΔH0(II)=-286.0kJ III. 4C(s) + 4H2(g) + O2(g) → C3H7COOH(ℓ) ΔH0(III)=-534.0kJ
استعن بهذه المعطيات، واحسب قيمة ΔH0(1) . فصّل حساباتك. - أجروا في المختبر التفاعل (2) الذي أمامك:
(2) C3H7COOH(g) + 5O2(g) → 4CO2(g) + 4H2O(g) ΔH0(2)=-2,065.6kJ
الجدول الذي أمامك يعرضقيَم إنتالبيات رباط.
احسب كمّيّة الطاقة التي يجب بذلها من أجل فكّ جميع الأربطة التساهميّة (الكوڤلنتيّة) في الموادّ المتفاعِلة في تفاعل 1 مول C3H7COOH(g). فصّل حساباتك.الرباط O–H (في جزيئات H2O) C=O (في جزيئات CO2) إنتالبيا الرباط (kJ⁄moℓ) 463 803
12. الحسابات الكيميائيّة
معدن المغنيسيوم، Mg(s)، يُستعمَل أساسًا في صناعة السيّارات والطيران. في أغلب الأحيان، يستعملون سبائك لِ Mg(s) مع الألومنيوم، Aℓ(s)، لكنّهم، في بعضالأحيان، يُضيفون إلى السبيكة كمّيّات ضئيلة من معادن أخرى، مثل التيتانيوم، Ti(s) (العدد الذرّيّ للتيتانيوم هو 22).- في 1 كغم من إحدى سبائك المغنيسيوم يوجد 0.1 غرام Ti(s) . احسب كم ذرّة Ti توجد في 1 كغم من هذه السبيكة. فصّل حساباتك. معطى أنّه: في مول واحد جسيمات يوجد 6.02×1023 جسيم.
- تركيز أيونات Mg2+(aq) تركيز أيونات 39.2 غرام في اللتر. احسب التركيز المولاريّ لأيونات Mg2+(aq) في مياه البحر الميّت. فصّل حساباتك.
- يُنتِجون من مياه البحر الميّت خليطًا يُسمّى كرنليت، الذي أحد مركِّباته هو كلوريد المغنيسيوم، MgCℓ2(s).
في إحدى مراحل إنتاج Mg(s) يَصْهَرون الكرنليت في درجة حرارة 700°C ويُمرِّرون عبره تيّارًا
كهربائيًّا.
في هذه الشروط يحدث التفاعل (1):
- فسّر لماذا يجب صَهْر الكرنليت قبل تمرير تيّار كهربائيّ عبره.
- احسب حجم غاز Cℓ2(g) الذي يَنتُج أثناء إنتاج 1 طنّ Mg(s). فصّل حساباتك. معطى أنّه: في 1 طنّ يوجد 1,000,000 غرام (1×106 غرام). في شروط التفاعل، حجم 1 مول غاز هو 80 لترًا.
- جزء من Cℓ2(g) الذي يُنتَج في مصنع المغنيسيوم يُستعمَل لإنتاج البروم، Br2(ℓ).
يَدفقون غاز Cℓ2(g) إلى محلول يحوي أيونات بروم Br‾(aq) .
يحدث التفاعل (2).
(2) Cℓ2(g) + 2Br‾(aq) → Br2(ℓ) + 2Cℓ ‾(aq)
تركيز أيونات Br‾(aq) في المحلول الذي يُستعمَل لإنتاج Br2(ℓ) هو 0.125M. احسب حجم المحلول اللازم لإنتاج 1,000 مول Br2(ℓ) . فصّل حساباتك. - أجروا في المختبر تجربة لإنتاج بروم حسب التفاعل (2).
دَفقوا غاز Cℓ2(g) إلى 100 ملل محلول يحوي أيونات Br‾(aq) بتركيز 0.5M. تفاعلت الموادّ بالكامل.
- احسب كتلة Br2(ℓ) الذي نتج. فصّل حساباتك.
- احسب حجم غاز Cℓ2(g) الذي تَفاعَلَ. فصّل حساباتك. معطى أنّه: في شروط التجربة، حجم 1 مول غاز هو 25 لترًا.
13. الأكسدة – الاختزال
يتناول السؤال القدرة النسبيّة لمعادن معيّنة على الاختزال والقدرة النسبيّة لأيونات مميَّئة على الأكسدة. أمامك قائمة لأيونات معدنيّة مميَّئة:Cu2+(aq) , Ag+(aq) , Fb2+(aq) , Zn2+(aq)
- أجروا في المختبر تجربة في مرحلتين.
في المرحلة الأولى غمسوا شريط نحاس، Cu(s)، في كأس تحوي محلولاً عديم اللون لنترات الفضّة، AgNO3(aq) .
في التفاعل الذي حدث، تفاعلت كلّ أيونات الفضّة Ag+(aq) .
تغيّر لون المحلول إلى أزرق فاتح، ونتج في قاع الكأس راسب رماديّ.
- اكتب معادلة صافية موازَنة للتفاعل الذي حدث في المرحلة الأولى من التجربة.
- اكتب معادلة صافية موازَنة للتفاعل الذي حدث في المرحلة الثانية من التجربة.
- رتِّب المعادن: نحاس، Cu(s)، وفضّة، Ag(s)، وخارصين، Zn(s)، حسب قدرتها النسبيّة على الاختزال من العالي إلى المنخفض. علّل إجابتك حسب نتائج مرحلتَي التجربة.
- المعادن المُعرَّضة للبيئة تمرّ بتآكل أحيانًا. لمنع التآكل يتّخذون وسائل حماية مختلفة.
- من أجل منع التآكل، يَطلون مواسير الحديد، Fe(s)، المطمورة في الأرضبخارصين، Zn(s) . طَلْي مواسير الحديد بالنحاس، Cu(s)، لا يمنع تآكل الحديد. حدِّد أيّ معدن، Cu(s) أم Zn(s)، هو مادّة مختزِلة أفضل من Fe(s). علّل تحديدك.
- تمثال الحرّيّة في نيويورك مبنيّ من أعمدة حديديّة موصولة بها ألواح نحاسيّة. في نقاط التماسّ بين الأعمدة الحديديّة والألواح النحاسيّة يحدث تآكل. فسّر لماذا يحدث تآكل في نقاط التماسّ هذه.
- رتِّب الأيونات Fe2+(aq) وَ Cu2+(aq) وَ Ag+(aq) وَ Zn2+(aq)، حسب قدرتها النسبيّة على الأكسدة، من العالي إلى المنخفض. اعتمد على المعلومات التي في البندين “أ” وَ “ب”.
- أيونات الهيدرونيوم، H3O+(aq)، يمكنها أن تتفاعل كمُؤكسِد..
عندما يغمسون شريط Fe(s) في محلول لحامضكلوريد الهيدروجين، HCℓ(aq)، يحدث التفاعل (1):
(1) Fe(s) + 2H3O+(aq) → Fe2+(aq) + H2(g) + 2H2O(ℓ)
حدِّد أيّ أيون من الأيونَيْن، H3O+(aq) أم Fe2+(aq)، هو مُؤكسِد أفضل. علّل.
14. الحوامض والقواعد والحسابات الكيميائيّة
في كلّ واحد من الوعاءين A وَ B يوجد 500 ملل ماء، H2O(ℓ). إلى الوعاء A دَفقوا 100 ملل غاز بروميد الهيدروجين، HBr(g) . إلى الوعاء B دَفقوا 100 ملل غاز أمونيا، NH3(g) .- א
- اكتب معادلة التفاعل الذي حدث في الوعاء A ومعادلة التفاعل الذي حدث في الوعاء B.
- حدِّد هل pH المحلول في كلّ واحد من الوعاءين A وَ B في نهاية التفاعل، كان أكبر من 7 أم أصغر من 7 أم يساوي 7. علّل.
- احسب التركيز المولاريّ للمحلول الذي نتج في الوعاء A . فصّل حساباتك. معطى أنّه: في شروط التفاعل، حجم 1 مول غاز هو 25 لترًا.
- إلى 100 ملل من المحلول الذي في الوعاء A ، أضافوا بالتدريج 900 ملل ماء، وقاسوا pH المحلول.
حدِّد أيّ رسم بيانيّ من الرسوم البيانيّة IV-I التي أمامك يصف صحيحًا التغيُّر في pH المحلول أثناء إضافة الماء. علّل.

- خلطوا 100 ملل من المحلول الذي في الوعاء A مع 20 ملل من محلول هيدروكسيد البوتاسيوم، KOH(aq).
حدث تفاعل. pH المحلول في نهاية التفاعل كان مساويًا لِ 7.
- اكتب معادلة صافية للتفاعل الذي حدث.
- احسب التركيز المولاريّ لمحلول KOH(aq). فصّل حساباتك وعلّل.
- عندما يَتَماسّ غاز HBr(g) مع غاز NH3(g)، يحدث التفاعل:
HBr(g) + NH3(g) → NH4Br(s)
المادّة الصلبة بروميد الأمونيوم، NH4Br(s)، التي تَنتُج في هذا التفاعل تذوب جيّدًا في الماء. حدِّد بالنسبة لكلّ واحد من القولين i وَ ii اللذين أمامك، إذا كان صحيحًا أم غير صحيح. علّل كلّ تحديد.- التفاعل بين HBr(g) وَ NH3(g) هو تفاعل حامض- قاعدة.
- المحلول المائيّ لِ NH4Br(aq) موصِل للتيّار الكهربائيّ.