امتحان بجروت في الكيمياء 2017
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان.
الفصل الأوّل – إلزاميّ – 40 درجة
الفصل الثاني – 60 درجة (3×20 درجة)
المجموع – 100 درجة - موادّ مساعدة يُسمح استعمالها: حاسبة (بما في ذلك الحاسبة البيانيّة).
- تعليمات خاصّة:
- انتبه: في الفصل الأوّل يوجد سؤالان إلزاميّان.
في السؤال 1 يوجد ثمانية بنود א – ח لكلّ بند معروضة أربع إجابات، عليك أن تختار الإجابة الصحيحة منها. عليك الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
في السؤال 2 عليكالإجابة عن جميع البنود. - في الفصل الثاني عليك الإجابة عن ثلاثة من خمسة أسئلة.
- انتبه: في الفصل الأوّل يوجد سؤالان إلزاميّان.
نتمنّى لك النّجاح!
الفصل الأوّل ( 40 درجة)
أجب عن السؤالين 1 وَ 2 (لكلّ سؤال – 20 درجة)
- أجب عن جميع البنود א – ח (لكلّ بند – 2.5 درجة)
لكلّ بند مقترَحة أربع إجابات 1 – 4.
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة، واختر الإجابة الأكثر ملاءمة.
- أشر إلى الإجابة التي اخترتَها في ورقة الإجابات التي في الغلاف الداخليّ في آخر دفتر الامتحان (صفحة 19).
- في كلّ بند، أشر بقلم حبر بِ # في المربّع الذي تحت الرقم ( 1- 4) الذي يدلّ على الإجابة التي اخترتَها.
- في كلّ بند يجب الإشارة بِ X واحد فقط.
- لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■
- يُمنَع المحو بالتيپكس.
- انتبه: من الجدير الامتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلاً بالإشارة إلى الإجابات الصحيحة في نموذج الامتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- الأحرف c ، b ، a هي رموز اعتباطيّة تمثّل ثلاثة عناصر في الترتيب الدوريّ. أمامك صِيَغ تمثيل إلكترونيّة لذرّات العناصر . c ، b ، a
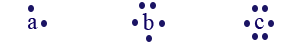 يمكن أن يحدث بين اثنين من هذه العناصر تفاعل يَنتُج فيه مركَّب أيونيّ. ما هي الصيغة الأمپيريّة الصحيحة لهذا المركَّب؟
يمكن أن يحدث بين اثنين من هذه العناصر تفاعل يَنتُج فيه مركَّب أيونيّ. ما هي الصيغة الأمپيريّة الصحيحة لهذا المركَّب؟- a5b2
- a2b3
- ac
- ac3
a מתכת מהטור השני ויש אל-מתכות מהטור ה-6. a כיון יהיה 2+, c כיון יהיה 2-. ולכן ac.
- نجح العلماء مؤخّرًا في أن يُنتِجوا بشكل اصطناعيّ أربعة عناصر جديدة أعدادها الذرّيّة: 113 وَ 115 وَ 117 وَ 118.
العنصر الذي عدده الذرّيّ 118 موجود في الترتيب الدوريّ تحت عنصر الرادون، 86Rn.
أمامك أربعة أقوال 1- 4. ما هو القول غير الصحيح؟- أربعة العناصر الجديدة موجودة في نفس المجموعة في الترتيب الدوريّ.
- لذرّات أربعة العناصر الجديدة عدد متساوٍ من مستويات الطاقة المملوءة.
- لذرّة العنصر الذي عدده الذرّيّ 118 توجد 8 إلكترونات في مستوى الطاقة الأعلى.
- أربعة العناصر الجديدة موجودة في نفس الدورة في الترتيب الدوريّ.
רק היסוד שמספרו האטומי 118 יהיה בטור השמיני מתחת ליסוד ראדון, 86Rn. כל השאר בטורים אחרים ולכן זהו המשפט הלא נכון.
- في الجدول الذي أمامك معلومات عن التوصيل الكهربائيّ لأربع موادّ صلبة
فقط جزء من المعلومات صحيح.المادّة التوصيل الكهربائيّ
في الحالة الصلبة
التوصيل الكهربائيّ
في الحالة السائلةروبيديوم، Rb(s) + + بروميد الروبيديوم، RbBr(s) + – چرافيت، Cچرافيت(s) – + ثاني أكسيد السيليكون، SiO2(s) – – ما هما المادّتان اللتان المعلومات التي في الجدول صحيحة بالنسبة لهما؟
- Rb(s) ו- RbBr(s)
- RbBr(s) ו- Cגרפיט(s)
- Rb(s) ו- Cגרפיט(s)
- Rb(s) ו- SiO2(s)
Rb(s) מתכת מוליכה במצב מוצק ובמצב נוזל בגלל ‾e ניידים. החומר צורן דו-חמצני SiO2(s) הוא חומר אטומרי, לא מוליך במצב מוצק וגם לא במצב נוזל. אין לו מטענים חשמליים ניידים (לא אלקטרונים ולא יונים ניידים).
- لمادّة الصلبة كربونات الأمونيوم، (NH4)2CO3(s)، تتحلّل في التسخين حسب التفاعل:
(NH4)2CO3(s) → 2NH3(g) + CO2(g) + H2O(g)
سخّنوا عيّنة من (NH4)2CO3(s).
قيست أحجام الغازات التي نتجت في شروط متساوية لدرجة الحرارة والضغط.
ما هو التحديد الصحيح بالنسبة لنواتج هذا التفاعل؟- عدد جزيئات NH3(g) يساوي عدد جزيئات H2O(g).
- حجم NH3(g) هو ضعف حجم CO2(g).
- حجم H2O(g) يساوي حجم (NH4)2CO3(s).
- كتلة H2O(g) تساوي كتلة CO2(g).
היות ויחס המקדמים שווה ליחס הנפחים של הגזים הנמצאים באותם תנאים של טמפרטורה ולחץ:CO2(g) NH3(g) 1 : 2 יחס מולים
⇓1 2 יחס נפחים
- خلطوا 400 ملل من محلول 0.4M KCℓ(aq) مع 400 ملل من محلول 0.8M MgCℓ2(aq).
ما هو التحديد الصحيح بالنسبة لتركيز أيونات Cℓ‾(aq) في المحلول الناتج؟- 0.6M، لأنّ حجم المحلول هو الضعف، ولذلك تركيز أيونات Cℓ‾(aq) هو نصف.
- 0.8M، لأنّه في المحلول الناتج يوجد 0.8 مول من أيونات Cℓ‾(aq).
- 1.0M، لأنّه في المحلول الناتج يوجد 0.8 مول من أيونات Cℓ‾(aq).
- 1.0M، لأنّ حجم المحلول هو الضعف وعدد المولات الكلّيّ لأيونات Cℓ‾(aq) هو 2 مول.
Cℓ‾(aq) KCℓ(aq) 1 : 1 יחס מולים 0.4 C (מול/ליטר) 0.4 V (ליטר) 0.16 0.16 n (מול) Cℓ‾(aq) MgCℓ2(aq) 2 : 1 יחס מולים 0.8 C (מול/ליטר) 0.4 V (ליטר) 0.64 0.32 n (מול)
- داخل وعاء مصنوع من معدن الفضّة، Ag(s)، خلطوا محلولين:
محلول نترات الفضّة، AgNO3(aq)، ومحلول نترات المغنيسيوم، Mg(NO3)2(aq).
معطى أنّ: أيونات Ag2+(aq) هي مؤكسِد أقوى من أيونات Mg2+(aq).
ما هو التحديد الصحيح؟- أيونات Ag2+(aq) تؤكسِد أيونات Mg2+(aq).
- أيونات Mg2+(aq) تؤكسِد أيونات Ag2+(aq).
- أيونات Mg2+(aq) تؤكسِد المعدن Ag(s).
- يمكن خزن المحلولين في وعاء مصنوع من معدن الفضّة، Ag(s).
אם כמחמצן Mg2+(aq)<Ag2+(aq)
אז כמחזרים Mg(s)>Ag(s)
ולכן ניתן לאחסן את שתי התמיסות בכלי שעשוי מתכת כסף, Ag(s). יוני Ag2+(aq) לא יגיבו עם Ag(s), וגם יוני Mg2+(aq) לא יקבלו מה- Ag(s) ‾e כי הוא מחזר פחות טוב מה- Mg(s)>Ag(s).
- حضّروا 50 ملل من كلّ واحد من المحاليل: Ca(NO3)2(aq) , HNO3(aq) , Ca(OH)2(aq)، وقاسوا ال pH الخاصّبها.
أضافوا إلى كلّ واحد من المحاليل 50 ملل ماء.
أيّ سطر من الأسطر 1- 4 التي في الجدول الذي أمامك يعرض صحيحًا التغيّر الذي طرأ على pH كلّ واحد من المحاليل؟
תמיסת Ca(NO3)2(aq) לא מכילה יוני H3O+(aq) או יוניOH‾(aq) ולכן ה- pH=7 וגם בעקבות הוספת מים ריכוזם יקטן וה- pH ירד ולכן התשובה היא 2.Ca(OH)2(aq) HNO3(aq) Ca(NO3)2(aq) 1 ارتفع انخفض لم يتغيّر 2 انخفض ارتفع لم يتغيّر 3 ارتفع انخفض انخفض 4 انخفض ارتفع ارتفع - معدن الخارصين، Zn(s)، يتفاعل مع محلول حامضيّ حسب التفاعل:
Zn(s) + 2H3O+(aq) → Zn2+(aq) + H2(g) + 2H2O(ℓ)
إلى وعاء زجاجيّ يحوي 50 ملل من محلول لحامضكلوريد الهيدروجين، HCℓ(aq)، بتركيز 1.0M، أدخلوا شريط خارصين كتلته 3 غرام. على أثر ذلك حدث تفاعل انطلق غاز خلاله، وكتلة شريط الخارصين انخفضت.
ما هي الطريقة الأكثر ملاءمة لزيادة وتيرة التفاعل؟- إجراء التفاعل في وعاء حجمه أكبر.
- إجراء التفاعل في وعاء مغلق مربوط بمحقنة.
- زيادة حجم محلول HCℓ(aq) إلى 100 ملل.
- إدخال 3 غرام من مسحوق الخارصين بدلاً من شريط الخارصين إلى الوعاء.
כי הגדלת שטח הפנים של באבץ תגרום ליותר התנגשויות בין חלקיקי המגיבים ולכן יותר התנגשויות פוריות ליחידת זמן.
تحليل قطعة من مقال علميّ – إلزاميّ
2. اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – ه” التي تليها (سؤال إلزاميّ – 20 درجة).
اكتشاف الغاز الطبيعيّ – فرصة تاريخيّة
اكتُشف في مطلع القرن الحادي والعشرين مجمّع كبير للغاز الطبيعيّ في المياه الاقتصاديّة لإسرائيل. الغاز الطبيعيّ الذي اكتُشف يحوي %99 ميثان، CH4(g).
في الوقت الحاضر، يُستعمَل الغاز الطبيعيّ في الأساس مادّة وقوديّة لتوليد الكهرباء في محطّات توليد الكهرباء، بدلاً من الفحم، C(s)، ومن موادّ وقوديّة مصدرها من النفط. النفط هو خليط هيدروكربونات (مر كَّبات من الكربون والهيدروجين). في تفاعل الحرق، تتفاعل الهيدروكربونات مع الأوكسجين، O2(g). ينتج ثاني أكسيد الكربون، CO2(g) وماء، H2O(ℓ)، وتنطلق طاقة تُستغَلّ لتوليد الكهرباء. التفاعل (1) هو تفاعل حرق الميثان.
(1) CH4(g) + O2(g) → CO2(g) + 2H2O(ℓ) ΔH0= – 890kJ
عندما تنطلق نفس كمّيّة الطاقة في حرق هيدروكربونات مختلفة، هناك أفضليّة للميثان، لأنّ حجم CO2(g) الذي ينتج في حرقه هو الأصغر. CO2(g) هو غاز يساهم في تفاقم أثر الاحتباس الحراريّ، ولذلك الانتقال إلى استعمال الغاز الطبيعيّ كمادّة وقوديّة يقلّص انطلاق CO2(g) إلى الغلاف الجوّيّ.
الميثان، الذي مصدره من الغاز الطبيعيّ، يمكنه أن يُستعمَل ليس فقط مادّة وقوديّة، وإنّما أيضًا مادّة متفاعِلة أوّليّة في الصناعة الكيميائيّة لإنتاج الهيدروجين، H2(g)، والميثانول، CH3OH(ℓ).
يتفاعل الميثان مع بخار الماء الساخن، H2O(aq)، حسب التفاعل (2):
(2) CH4(g) + H2O(g) → CO(g) + 3H2(g)
خليط الغازَيْن CO2(g) وَ H2(g) الذي ينتج في التفاعل (2) يُسمّى سينغاز (syngas)، وهو مصدر للهيدروجين في الصناعة الكيميائيّة.
يُستغَلّ الهيدروجين، من ضمن استغلالات أخرى، لإنتاج الأمونيا، NH3(g)، التي هي عبارة عن مادّة متفاعِلة أوّليّة في صناعة الأسمدة.
يمكن من السينغاز أيضًا إنتاج ميثانول، CH3OH(ℓ)، حسب التفاعل ( 3):
(3) CO(g) + H2(g) → CH3OH(ℓ)
يمكن من الميثانول إنتاج موادّ تُستعمَل موادّ خامة في صناعة البلاستيكوالنسيج والألوان والأدوية.
يمكن من الميثانول أيضًا إنتاج ثنائيّ مثيل الأثير، CH3OCH3(g)، حسب التفاعل (4) :
(4) 2CH3OH(ℓ)→ CH3OCH3(g) + H2O(ℓ)
سيُستعمَل ثنائيّ مثيل الأثير في المستقبل وقودًا بديلاً في محرِّكات الديزل في وسائل المواصلات الثقيلة وفي الصناعة.
اكتشاف الغاز الطبيعيّ يُمكِّن تقليصتعلُّق دولة إسرائيل باستيراد الفحم والنفط الخام من الدول الأخرى ويُتيح الفرصة لتنمية مجتمع علميّ – تكنولوجيّ متقدّم.
المصادر:
http://www.ynet.co.il/articles/0.7340.L-4386628.11.html
טישלר, א’ הרט, ד’ (2012) מפעל לייצור מתאנול מגז טבעי ברמת חובבף תקציר מנהלים.
- حسب القطعة، اذكر ثلاث أفضليّات لاستعمال الغاز الطبيعيّ الذي اكتُشف في المياه الاقتصاديّة لإسرائيل.
- בשריפת מתאן נפלט פחות CO2(g) לאוויר מקטין את הפגיעה באפקט החממה.
- ניתן לייצר בעזרתו את גז המימן שמהווה חומר מוצא לייצור אמוניה, NH3(g), שהיא חומר חשוב בתעשייה.
- ניתן בעזרתו לייצר מתאנול, CH3OH(ℓ), שגם הוא משמש להפקת חומרים הנדרשים בתעשיית הפלסטיק.
- מפחית את התלות של מדינת ישראל ביבוא נפט גולמי ופחם.
- משמש חומר דלק במקום פחם ונפט.
- أثناء الاستهلاك الأقصى للكهرباء، يحرقون في محطّات توليد الكهرباء أيضًا موادّ وقوديّة مصدرها من النفط، كالسولار والمازوط. أحد مركِّبات السولار هو هيدروكربون صيغته C13H28.
أمامك معادلة تفاعل حرق C13H28(ℓ):
C13H28(ℓ) + 20 O2(g) → 13CO2(g) + 14H2O(g)
- احسب عدد مولات CO2(g) التي تنتج في تفاعل حرق C13H28(ℓ) الذي تنطلق فيه 890kJ. فصّل حساباتك.
CO2(g) (מול) אנרגיה (kJ) 13 : 8740 1.323 890 - ما هو عدد مولات CO2(g) التي تنتج في تفاعل حرق CH4(g) الذي تنطلق فيه 890kJ.
CO2(g) (מול) אנרגיה (kJ) 1 : 890 1 890 - حدِّد إذا كانت إجابتاك عن البندين الفرعيّين i وَ ii تلائمان المعلومات الواردة في القطعة بالنسبة لحجم CO2(g) الذي ينتج في تفاعل حرق CH4(g) לبالمقارنة مع حرق هيدروكربونات أخرى. علّل. כן. התשובות תואמות כי בשריפת המתאן ליצירת אותה כמות אנרגיה נוצרים פחות מולים של גז פחמן דו-חמצני.
- احسب عدد مولات CO2(g) التي تنتج في تفاعل حرق C13H28(ℓ) الذي تنطلق فيه 890kJ. فصّل حساباتك.
- خليط من %15 ميثانول وَ %85 بنزين يُستعمَل وقودًا نوعيًّا للسيّارات، ويُسمّى M15. البنزين هو خليط هيدروكربونات. فسّر لماذا يذوب الميثانول في البنزين. בין מולקולות המתאנול ישנן אינטראקציות ואן דר ואלס וקשרי מימן. בין מולקולות תערובת הפחמימנים ישנן אינטראקציות ואן דר ואלס. נוצרות אינטראקציות ואן דר ואלס בין מולקולות האתאנול לבין המולקולות שבבנזין ולכן המתאנול מתמוסס בבנזין.
- التخطيط الذي أمامك يعرضبصورة تخطيطيّة جزءًا من العمليّات المذكورة في القطعة. انسخ التخطيط إلى دفترك، واكتب صيغة المادّة الملائمة في كلّ واحد من المستطيلات.
תשובהCH3OCH3(g) → → CO(g)+H2(g) → ↓ CH3OCH3(g) → CH3OH(ℓ) → CO(g)+H2(g) → CH4(g)+H2O(g) ↓ NH3(g) - هناك مَن يرى أنّ الغاز الطبيعيّ الذي اكتُشف في إسرائيل يجب أن يُستعمَل فقط مادّة وقوديّة في محطّات توليد الكهرباء وفي الصناعة. اكتب حجاجًا واحدًا يؤيّد هذا الرأي أو حجاجًا واحدًا يعارضه. علّل. טיעון בעד: יש לשמר עד כמה שניתן את כמויות המתאן. בעתיד הם יהוו יתרון אסטרטגי כשמאגרי הנפט יגמרו. וכן שימוש בהם מקטין את פליטת הפחמן הדו חמצני ובכך הפגיעה בסביבה קטנה יותר. טיעון נגד: לאפשר לכל התעשיות לנצל את משאב הטבע שהוא זול יותר ופחות מזהם ובעזרתו להוריד מחירים למגוון מוצרים גדול יותר ועל ידי כך להקל התושבים במדינה . ניתן לייצר מגוון גדול של מוצרים ולפתח את התעשייה הכימית בישראל.
3. مبنى الذرّة وصفات الموادّ
يتناول السؤال عنصر الهيدروجين وبعضًا من استعمالاته.
- لعنصر الهيدروجين ثلاثة نظائر طبيعيّة ولها أسماء مختلفة: هيدروجين، H وديوتريوم، D ، وتريتيوم، T . رمز ذرّة الهيدروجين هو .
ذرّة D أثقل بمرّتين من ذرّة H ، بينما ذرّة T أثقل بِ 3 مرّات من ذرّة H.- اكتب رمز ذرّة D وذرّة T.
- أحد النظائر الثلاثة H وَ D وَ T فقط، يُطلِق أشعّة ذات نشاط إشعاعيّ.
نشير إلى هذا النظير بالحرف X.
أمامك معادلة العمليّة التي يُطلِق فيها النظير X أشعّة ذات نشاط إشعاعيّ.حدِّد ما هو نظير عنصر الهيدروجين المُشار إليه بالحرف X. علّل.
האיזוטופ הוא .
בקרינת β המספר האטומי גדל ב-1 ומספר המסה אינו משתנה ולכן לאיזטופ X היה תיאור .
- اكتب رمز ذرّة D وذرّة T.
- درجة حرارة غليان، Tb، للهيدروجين السائليّ، H2(ℓ)، هي منخفضة جدًّا،, Tb=20K. فسّر لماذا.
בין מולקולות המימן יש רק אינטראקציות ואן דר ואלס. ענן האלקטרונים של מולקולות המימן קטן מאוד (2 אלקטרונים), ולכן אינטראקציות הואן דר ואלס בין המולקולות חלשות מאוד ונדרשת אנרגיה קטנה מאוד לניתוק אינטראקציות אלה וטמפרטורת הרתיחה של המימן נמוכה מאוד. - يستعملون غاز الهيدروجين، H2(g)، من أجل منع انطلاق مركَّبات كبريت سامّة إلى الهواء أثناء حرق الموادّ الوقوديّة التي تُستخرَج من النفط الخام.
توجد في هذه الموادّ الوقوديّة مركَّبات كبريت، مثل پنتان-ثيول، CH3(CH2)3CH2SH(ℓ). في شروط ملائمة، يتفاعل الهيدروجين مع پنتان-ثيول.
ناتِجا التفاعل هما كبريتيد الهيدروجين، H2S(g)، وپنتان، CH3(CH2)3CH3(ℓ).- اكتب معادلة موازَنة للتفاعل بين H2(g) وَ CH3(CH2)3CH2SH(ℓ).
CH3(CH2)3CH2SH(ℓ) + H2(g) → CH3(CH2)3CH3(ℓ)+H2S(g) - حدِّد إذا كان H2(g) في هذا التفاعل يتفاعل كمؤكسِد أم كمختزِل. علّل.
המימן עולה בדרגת החמצון מ- 0 ל- 1+ ולכן מוסר אלקטרונים הוא עובר תהליך חמצון והוא מגיב כמחזר.
- اكتب معادلة موازَنة للتفاعل بين H2(g) وَ CH3(CH2)3CH2SH(ℓ).
- يمكن أن يُستعمَل غاز الهيدروجين، H2(g)، أيضًا كمادّة وقوديّة للسيّارات.
يمكن إنتاج H2(g) في تفاعل بين هيدريد المغنيسيوم، MgH2(s)، والماء، H2O(ℓ).
حسب التفاعل (1).(1) MgH2(s) + H2O(ℓ) → Mg(OH)2(s) + 2H2(g)
- حدِّد إذا حدث انتقال إلكترونات في التفاعل (1). علّل.
ניתן לראות על פי הניסוח שאטומי המימן משנים את דרגות החמצון שלהם ולכן יש מעברי אלקטרונים בתגובה.
- يقترح العلماء استعمال MgH2(s) “مادّة خزن” يُنتَج منها الهيدروجين.
احسب كتلة MgH2(s) הاللازمة لإنتاج 10,000 لتر H2(g). فصّل حساباتك.
معطى أنّه: في شروط التفاعل حجم 1 مول غاز هو 25 لترًا.MgH2(s) H2(g) 1 : 2 יחס מולים 10,000 V (ליטר) 25 Vm (ליטר/מול) 200 n (מול) 26.31 Mw (גרם/מול) m=n× Mw=5262 m (גרם) המסה של של MgH2(s) הדרושה לקבלת 10,000 ליטר H2(g) היא 5262 גרם.
- حدِّد إذا حدث انتقال إلكترونات في التفاعل (1). علّل.
4. כימיה של מזון
يوصي خبراء التغذية بتناول الجوز كلّ يوم، لأنّه غنيّ، من ضمن موادّ أخرى، بالأحماضالدهنيّة المتعدّدة غير المشبعة التي تساعد على منع الأمراض.
- أمامك تمثيل مختصر للصيغتين البنائيّتين لحامضين دهنيّين، I وَ II.
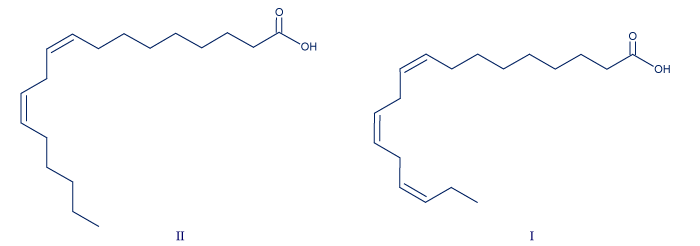
- اكتب كتابة مختصرة لكلّ واحد من الحامضين الدهنيّين I وَ II.
C18:3ω3 all cis .I
C18:2ω6 all cis .II - الصيغتان I وَ II هما تمثيل مختصر للصيغتين البنائيّتين لحامضين دهنيّين موجودَيْن في الجوز: حامض لينولييك وحامض ألفا-لينولينيك.
درجة حرارة انصهار حامضألفا-لينولينيك هي أقلّ من درجة حرارة انصهار حامض لينولييك.
حدِّد أيّة صيغة من الصيغتين، I أم II ، هي تمثيل مختصر للصيغة البنائيّة لحامض ألفا-لينولينيك. علّل تحديدك.
החומצה האלפא-לינולנית היא I כי במבנה המולקולה ישנם יותר קשרים כפולים. נוצרים במולקולה יותר אזורים מכופפים ולכן האריזה במצב מוצק פחות צפופה. אינטראקציות הואן דר ואלס בין המולקולות שלה חלשות יותר נדרשת פחות אנרגיה לניתוק אינטראקציות הואן דר ואלס בין המולוקלות ולכם טמפרטורת ההיתוך שלה נמוכה יותר.
- اكتب كتابة مختصرة لكلّ واحد من الحامضين الدهنيّين I وَ II.
- حدِّد بالنسبة لكلّ واحد من القولين i وَ ii اللذين أمامك إذا كان صحيحًا أم غير صحيح. علّل كلّ تحديد.
- حامض ألفا-لينولينيك هو إيزومير لحامض لينولييك.
ההיגד אינו נכון. החומצות אינן איזומרים כי יש להן הרכב כימי שונה (נוסחה מולקולרית שונה). - يمكن الحصول على حامضلينولييك من حامضألفا-لينولينيك في عمليّة هدرجة مراقَبة (ضمّ إضافة) هيدروجين.
ההיגד נכון. בהידרוגנציה מבוקרת ניתן לפרק רק את הקשר הכפול הראשון בין אטומי פחמן 3 ל-4 ועל ידי כך לקבל את החומצה הלינולאית.
- حامض ألفا-لينولينيك هو إيزومير لحامض لينولييك.
- الجدول الذي أمامك يعرض معلومات عن كتلة الأحماض الدهنيّة الأساسيّة في 100 غرام جوز من ثلاثة أنواع: الجوز البرازيليّ والجوز الشائع والفستق.
نوع الجوز كتلة الأحماضالدهنيّة (غرام) حامض ألفا-لينولينيك حامض لينولييك حامض الأولييك الجوز البرازيليّ 0.04 20.5 24.2 الجوز الشائع 9.1 38.1 8.8 الفستق 0.003 15.7 24.0 الكتابة المختصرة لحامضالأولييك هي: C18:1ω9cis.
أيّ نوع من ثلاثة أنواع الجوز هو الأغنى بأحماضدهنيّة متعدّدة غير مشبعة؟
فصّل حساباتك وعلّل.אגוזי אדמה (בוטנים) אגוזי מלך אגוזי ברזיל 15.703 47.2 20.54 מסה כוללת של חומצות שומן רב-בלתי-רוויות (גרם) נחשב את אחוז חומצות השומן הרב-בלתי-רוויות בעזרת הנוסחה: 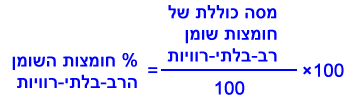
15.703% 47.2% 20.54% אחוז חומצות שומן רב-בלתי-רוויות אגוזי מלך הם העשירים ביותר בחומצות שומן רב-בלתי-רוויות.
- الجوز غنيّ أيضًا بمضادّات أكسدة (أنتي أكسيدينتات) مثل ڤيتامين E.
من بين الأقوال 1-4 التي أمامك، اذكر ما هي الأقوال الملائمة لوصف نشاط ڤيتامين E كمضادّ أكسدة.
ڤيتامين E:- يتفاعل كمؤكسِد في عمليّات الأكسدة-الاختزال.
- يُبطِل النشاط الضارّ للراديكالات الحرّة.
- يمرّ بأكسدة خلال نشاطه.
- يمنع عمليّات أكسدة غير مرغوب فيها في الجسم.
ההיגדים המתאימים הם 2,3 ו-4.
5. المبنى والترابط وحالة الغاز
الغازان إيثان، C2H6(g)، والميثانال، H2CO(g)، يُستعمَلان مادّتين متفاعِلتين أوّليّتين في صناعة الموادّ البلاستيكيّة.
- اذكر مميّزين في المستوى الميكروسكوبيّ للغاز الموجود في وعاء مغلق.
מאפיין ראשון: צפיפות נמוכה.(אפשר גם כוחות בין מולקולרים חלשים/מרחק גדול בין המולקולות יחסית לגודל המולקולות)
מאפיין שני: תנועת מעתק, סיבוב, תנודה.
מאפיין נוסף: המולקולות מתנגשות בינן לבין עצמן ובדפנות הכלי
מאפיין נוסף: הגז מורכב ממולקולות - الميثانال، H2CO(g)، يذوب في الماء، H2O(ℓ) ، وفي البنزين أيضًا، C6H6(ℓ).
- حدِّد أيّ رسم توضيحيّ من الرسوم التوضيحيّة III-I التي أمامك هو وصف تخطيطيّ صحيح للأربطة الهيدروجينيّة التي يمكن أن تتكوّن بين جزيء الميثانال وجزيئات الماء.
فسّر لماذا دحضتَ الرسمين التوضيحيّين الآخرين.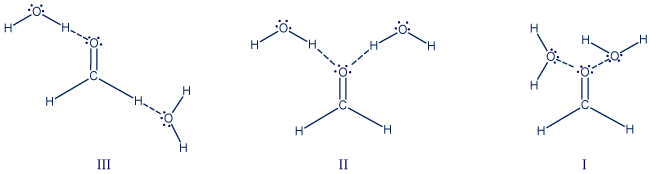 האיור הנכון הוא איור II.
האיור הנכון הוא איור II.
איור I אינו נכון כי מצויר קשר בין זוגות אלקטרונים לא קושרים.
איור III אינו נכון כי אטומי המימן בחומר H2CO(g) אינם חשופים מאלקטרונים ואינם יכולים ליצור קשרי מימן. - اكتب معادلة عمليّة إذابة الميثانال في البنزين.
- حدِّد أيّ رسم توضيحيّ من الرسوم التوضيحيّة III-I التي أمامك هو وصف تخطيطيّ صحيح للأربطة الهيدروجينيّة التي يمكن أن تتكوّن بين جزيء الميثانال وجزيئات الماء.
- يُبرِّدون تدريجيًّا الغازَيْن C2H6(g) وَ H2CO(g)، كلّ غاز في وعاء آخر.
الغاز الأوّل الذي يتكاثف (يتحوّل إلى سائل) هو الميثانال، H2CO(g).
فسّر لماذا يتكاثف الغاز H2CO(g) أوّلاً.
H2CO(g) הוא חומר מולקולרי שבין המולקולות שלו אינטראקציות ואן דר ואלס חזקות מאינטראקציות הואן דר ואלס שקיימות בין מולקולות C2H6(g) ולכן טמפרטורת הרתיחה שלו גבוהה יותר והוא מתעבה ראשון.
الإيثان، C2H6(g)، يتفاعل مع الأوكسجين، O2(g), ، حسب التفاعل:
2C2H6ׂׂ(g) + 7O2(g) → 4CO2(g) + 6H2O(g)
أجروا تجربتين. في كلّ واحدة من التجربتين أدخلوا إلى وعاء عيّنة من C2H6(g) وكمّيّة ملائمة من O2(g) وأشعلوا خليط الغازَيْن.
- في التجربة الأولى أجروا التفاعل في وعاء مغلق حجمه ثابت. خلال التجربة حافظوا على درجة حرارة ثابتة وقاسوا ضغط الغاز داخل الوعاء.
حدِّد أيّ رسم بيانيّ من الرسوم البيانيّة III – I التي أمامك يصف صحيحًا تغيُّر ضغط الغاز داخل الوعاء. علّل. הגרף המתאים הוא גרף III. כי על פי הניסוח הנתון חלה עליה במספר המולים של בגז בכלי (על פי המקדמים של התגובה) ולכן הלחץ גדל.
הגרף המתאים הוא גרף III. כי על פי הניסוח הנתון חלה עליה במספר המולים של בגז בכלי (על פי המקדמים של התגובה) ולכן הלחץ גדל. - في التجربة الثانية أجروا التفاعل في وعاء مغلق شكله محقنة.
أدخلوا إلى الوعاء 0.02 مول C2H6(g) وكمّيّة ملائمة من O2(g) ، وأشعلوا خليط الغازَيْن. تفاعل الغازان بالكامل.
خلال التجربة حافظوا على ضغط ثابت وعلى درجة حرارة ثابتة.
في نهاية التفاعل قاسوا حجم الوعاء.
في شروط التجربة، حجم 1 مول غاز هو 30 لترًا.- احسب حجم الأوكسجين الذي تفاعل. فصّل حساباتك.
O2(g) C2H6(g) 7 : 2 יחס מולים 0.07 0.02 n (מול) 30 Vm (ליטר/מול) V=n×Vm=2.1 V (ליטר) נפח החמצן, O2(g), שיגיב הוא 2.1 ליטר.
- ما هو حجم الوعاء الذي قيس في نهاية التجربة؟ فصّل حساباتك وفسّر.
H2O(g) CO2(g) O2(g) 6 : 4 : 7 יחס מולים / נפחים 1.8 1.2 2.1 נפח (ליטר) הנפח הנמדד הוא: 3 ליטר שהוא סכום הנפחים: 1.2+1.8.
- احسب حجم الأوكسجين الذي تفاعل. فصّل حساباتك.
6. الأكسدة -الاختزال والأحماض والقواعد والحسابات الكيميائيّة
يتناول السؤال تفاعلات لمادّتين: أمونيا، NH3(g)، وحامضالنيتريك، HNO3(ℓ). تُستعمَل هاتان المادّتان في الصناعة الكيميائيّة، وبضمن ذلك لإنتاج الأسمدة.
- في شروط معيّنة، تتفاعل الأمونيا، NH3(g)، مع محلول يحوي أيونات بيكربونات، HCO3‾(aq)، حسب التفاعل (1):
(1) NH3(g) + HCO3‾(aq)→NH4+(aq) + CO32-(aq)- التفاعل (1) هو تفاعل حامض- قاعدة. فسّر لماذا.
התגובה היא תגובת חומצה-בסיס כי יש מעבר פרוטון בתגובה. האמוניה מקבלת פרוטון והיון מימן פחמתי מוסר פרוטון. - تفاعلت 750 ملل من NH3(g) הגיבו עם 150مع 150 ملل من محلول بيكربونات الصوديوم، NaHCO3(aq), تفاعلت الموادّ المتفاعِلة بالكامل.
في شروط التفاعل، حجم 1 مول من الغاز هو 25 لترًا.
احسب التركيز المولاريّ لأيونات HCO3‾(aq) في المحلول. فصّل حساباتك.HCO3‾(aq) NH3(g) 1 : 1 יחס מולים 0.75 V (ליטר) גז 25 Vm (ליטר/מול) 0.03 n (מול) 0.15 V (ליטר) תמיסה C (מול/ליטר) ריכוז היון מימן פחמתי בתמיסה הוא 0.2M.
- التفاعل (1) هو تفاعل حامض- قاعدة. فسّر لماذا.
- المادّتان، NH3(g) وَ HNO3(ℓ)، تتفاعلان بتفاعلات أكسدة – اختزال.
- تطرّق إلى ذرّات N ، وحدِّد أيّة مادّة من المادّتين يمكنها أن تتفاعل كمختزِل فقط. علّل.
אטומי החנקן בחומר NH3(g) הם בעלי דרגת חמצון 3- היות וזו דרגת החמצון המינימלית של החנקן הוא יכול רק למסור אלקטרונים ולשמש במחזר בלבד (בחומר השני דרגת החמצון של החנקן היא 5+ ולכן הוא יכול רק לקבל אלקטרונים ולתפקד כמחמצן). - تتفاعل الأمونيا، NH3(g)، مع محلول فوق أكسيد الهيدروجين، H2O2(g).
حدِّد أيّة مادّة يمكنها أن تكون أحد نواتج التفاعل: O2(g) أم H2O(ℓ) علّل.
החומר הוא H2O2(ℓ) כי אטומי החנקן יכולים לשמש רק כמחזר כפי שהסברנו בתת סעיף הקודם. לכן אטומי החמצן בחומר H2O2(ℓ) שדרגת החמצון שלהם היא 1- יקבלו אלקטרון וישמשו כמחמצן ויהפכו לאטומי חמצן בעלי דרגת חמצון 2- כמו במולקולת המים. - يتفاعل محلول HNO3(aq) מمع الكربون، C(s)، حسب التفاعل (2):
(2) 4H3O+(aq) + 4NO3‾(aq) + 3C(s) → 4NO(g) + 3CO2(g) + 6H2O(ℓ)- حدِّد كم مول إلكترونات تمرّ في التفاعل الذي يتفاعل فيه 0.15 مول C(s). فصّل حساباتك.
e‾ C(s) 12 : 3 יחס מולים 0.6 0.15 n (מול) בתגובה עוברים 0.6 מול אלקטרונים.
- تطرّق إلى ذرّات N ، وحدِّد أيّة مادّة من المادّتين يمكنها أن تتفاعل كمختزِل فقط. علّل.
- يتفاعل محلول HNO3(aq) مع أكسيد المغنيسيوم، MgO(s)، حسب التفاعل (3).
(3) MgO(s) + 2H3O+(aq) + 2NO3‾(aq) → Mg2+(aq) + 2NO3(g) + 3H2O(ℓ)
في كلّ واحد من الوعاءين A وَ B يوجد 200 ملل من محلول HNO3(aq) بتركيز 0.5M.
إلى الوعاء A أدخلوا 1.0 غرام MgO(s).
إلى الوعاء B أدخلوا 1.5 غرامMgO(s).
في نهاية التفاعل، pH المحلول في كلّ واحد من الوعاءين A وَ B ما زال حامضيًّا.
حدِّد في أيّ وعاء من الوعاءين— A أم B—ال pH في نهاية التفاعل كان أقلّ. علّل تحديدك.
היות ובכלי A הגיבו פחות מולים של MgO(s) כי המסה שלו קטנה יותר, אז הגיבו גם פחות מולים של יוני H3O+(aq) ולכן נותרה בתמיסה כמות גדולה יותר של מולים של יוני H3O+(aq). ריכוזם גדול יותר ולכן ה- pH של תמיסה זו קטן יותר.
7. المبنى والترابط والطاقة
يتناول السؤال جوانب طاقويّة تتعلّق بعناصر من عائلة الهالوجينات.
- قيمة إنتالبيا التبخير، ΔH0V، للبروم، Br2(ℓ)، في درجة حرارة الغليان, هي:
.حدِّد أيّ وصف بيانيّ من الأوصاف البيانيّة الثلاثة III-I التي أمامك يمثّل صحيحًا تغيُّر الإنتالبيا في عمليّة تبخير Br2(ℓ). علّل تحديدك.

גרף III הוא הגרף הנכון כי הוא מתאר תהליך אידוי שבו לתוצרים אנרגיה פנימית גבוהה יותר כי במעבר מברום נוזל לברום גז יש להשקיע אנרגיה לפירוק האינטראקציות הבין מולקולוריות.Br2(ℓ) → Br2(g) ΔH0=30kJ
- الجدول الذي أمامك يعرضقيَم ΔH0V لثلاثة عناصر من عائلة الهالوجينات.
היסוד אנתלפיית אידוי ΔH0V
Cℓ2(ℓ) 20.4 Br2(ℓ) 30.0 I2(ℓ) 41.8 أمامك قيمتان لإنتالبيا تبخير، ΔH0V: وَ .
حدِّد أيّة قيمة من هاتين القيمتين هي القيمة التي تلائم ΔH0V الفلور، F2(ℓ). علّل تحديدك.
הערך הוא כי בין מולקולות הפלואור ישנן אינטראקציות ואן דר ואלס היות וענן האלקטרונים שלו קטן מבין כל ההלוגנים אינטראקציות הואן דר ואלס בין המולקולות שלו הם החלשות ביותר ונדרשת אנרגיה קטנה יותר לניתוק אינטראקציות אלה. - الجدول الذي أمامك يعرضقيَمًا لإنتالبيا الرباط.
الرباط H–Cℓ Br–Br H–Br Cℓ–Cℓ إنتالبيا الرباط
431 193 366 242 - فسّر لماذا قيمة إنتالبيا الرباط Br–Br هي أكبر من قيمة إنتالبيا التبخير، ΔH0V، للبروم، Br2(ℓ).
בפירוק הקשר בין אטומי הברום מפרקים קשר קוולנטי שהוא חזק יותר מאינטראקציות הואן דר ואלס שקיימות בין מולקולות הברום ומתנתקות בתהליך האידוי ולכן אנתלפיית הקשר של הברום גדולה מאנתלפיית האידוי של ברום. - اذكر ما هو العامل لكون قيمة إنتالبيا الرباط Cℓ–Cℓ أكبر من قيمة إنتالبيا الرباط Br–Br.
הרדיוס של אטומי הכלור קטן מהרדיוס של אטומי הברום.
- فسّر لماذا قيمة إنتالبيا الرباط Br–Br هي أكبر من قيمة إنتالبيا التبخير، ΔH0V، للبروم، Br2(ℓ).
- ד
- الكلور، Cℓ2(g)، يتفاعل مع بروميد الهيدروجين، HBr(g)، حسب التفاعل (1):
(1) Cℓ2(g) + 2HBr(g) → Br2(ℓ) + 2HCℓ(g)
استعن بالمعطيات التي في الجدول، واحسب قيمة ΔH0 للتفاعل (1).
فصّل حساباتك.ΔH0 = ΔH0(Cℓ–Cℓ) + 2ΔH0(H–Br) – [ΔH0(Br–Br) + 2ΔH0(H–Cℓ)] =
= 242+2×366-(193+2×431) = -81kJ
- الكلور، Cℓ2(g)، يتفاعل مع بروميد الهيدروجين، HBr(g)، حسب التفاعل (1):
- الكلور، Cℓ2(g)، يتفاعل مع بروميد الهيدروجين، HBr(g) حسب التفاعل (2) أيضًا:
(2) Cℓ2(g) + 2HBr(g) → Br2(ℓ) + 2HCℓ(g)
استعن بالمعطيات التي في السؤال، واحسب قيمة ΔH0 للتفاعل (2).
فصّل حساباتك.
נתון:
Br2(ℓ) → Br2(g) ΔH0=30kJ
נהפוך את התגובה ונסכום אותה עם התגובה שחישבנו בתת סעיף הקודם:Br2(g)→ Br2(ℓ) ΔH0=-30kJ
Cℓ2(g) + 2HBr(g) →Br2(g)+ 2HCℓ(g) ΔH0=-81kJCℓ2(g) + 2HBr(g) → Br2(ℓ) + 2HCℓ(g) ΔH0=-111kJ