بچروت في الكيمياء 2018
- مدّة الامتحان: ثلاث ساعات.
- مبنى النّموذج وتوزيع الدّرجات: في هذا النّموذج فصلان.
الفصل الأوّل – إلزاميّ – 40 درجة
الفصل الثاني – 60 درجة (3×20 درجة)
المجموع – 100 درجة - موادّ مساعدة يُسمح استعمالها: حاسبة (بما في ذلك الحاسبة البيانيّة).
- تعليمات خاصّة:
- انتبه: في الفصل الأوّل يوجد تسعة أسئلة إلزاميّة.
في كلّ واحد من الأسئلة 1-8 معروضة أربع إجابات، عليك أن تختار الإجابة الصحيحة منها. عليك الإشارة إلى الإجابات الصحيحة في ورقة الإجابات التي في آخر دفتر الامتحان (صفحة 19).
في السؤال 9 عليكالإجابة عن جميع البنود. - في الفصل الثاني يوجد خمسة أسئلة. عليك الإجابة عن ثلاثة منها.
- انتبه: في الفصل الأوّل يوجد تسعة أسئلة إلزاميّة.
التّعليمات في هذا النّموذج مكتوبة بصيغة المذكّر وموجّهة للممتحَنات وللممتحَنين على حدّ سواء.
نتمنّى لك النّجاح!
الأسئلة
الفصل الأوّل (40 درجة)
أجب عن ثمانية الأسئلة 8-1 (لكلّ سؤال – 2.5 درجة).
قبل أن تجيب، اقرأ جميع الإجابات المقترَحة.
لكلّ سؤال مقترَحة أربع إجابات. اختر الإجابة الأكثر ملاءمة.
- أشر إلى الإجابة التي اخترتَها في ورقة الإجابات التي في الغلاف الداخليّ في آخر دفتر الامتحان (صفحة 19).
- في كلّ سؤال، أشر بقلم حبر ب X في المربّع الذي تحت الحرف )أ-د( الذي يدلّ على الإجابة التي اخترتَها.
- في كلّ سؤال يجب الإشارة ب X واحد فقط.
- لمحو إشارة يجب ملء كلّ المربّع على النحو التالي: ■
- يُمنَع المحو بالتيپكس.
- انتبه: من الجدير الامتناع قدر الإمكان عن المحو في ورقة الإجابات، لذلك يوصى أوّلاً بالإشارة إلى الإجابات الصحيحة في نموذج الامتحان نفسه، وبعد ذلك فقط الإشارة إليها في ورقة الإجابات.
- معطى اثنان من نظائر الروبيديوم: وَ .
من بين هذين النظيرين، فقط النظير 87Rb يُطلِق أشعّة ذات نشاط إشعاعيّ.
ما هو التحديد الصحيح؟- عندما يُطلِق النظير أشعّة β ، يَنتُج النظير .
- عدد النيوترونات في النظير 87Rb يساوي عدد النيوترونات في النظير 85Rb.
- عدد الإلكترونات في ذرّة متعادلة لِ 87Rb أكبر من عدد الإلكترونات في ذرّة متعادلة لِ 85Rb.
- المركَّب 87RbCℓ(s) لا يُطلِق أشعّة ذات نشاط إشعاعيّ.
הסבר
בקרינת β המספר האטומי גדל ב- 1, מספר המסה אינו משתנה. - الحرفان X وَ Z هما رمزان اعتباطيّان يمثّلان عنصرين في الدورة الثالثة )السطر الثالث( في الترتيب الدوريّ.
العنصر X موصِل للكهرباء في الحالة الصلبة.
العنصر Z غير موصِل للكهرباء في الحالة الصلبة.
ما هو القول الصحيح؟- طاقة تأيُّن ذرّة العنصر X أعلى من طاقة تأيُّن ذرّة العنصر Z.
- نصف قطر ذرّة العنصر X أكبر من نصف قطر ذرّة العنصر Z.
- المركَّب الذي يَنتُج من العنصرين X وَ Z هو غاز في درجة حرارة الغرفة.
- صيغة مركَّب العنصر X مع الهيدروجين، H، هي XH4.
הסבר
יסוד X הוא מתכת.
יסוד Z הוא אל-מתכת.היות והם באותה השורה אס ליסוד X וליסוד Z יש אותו מספר של רמות אנרגיה, אבל ליסוד Z מספר פרוטונים גדול יותר בגרעין, ולכן הרדיוס האטומי שלו קטן יותר. - أمامك تمثيل مختصر للصيغتين البنائيّتين لجزيئَي المادّتين: يوريا وأستون.
 ما هو القول الصحيح؟
ما هو القول الصحيح؟- العدد الكلّيّ للإلكترونات في جزيء اليوريا أكبر من العدد الكلّيّ للإلكترونات في جزيء الأستون.
- في جزيئَي المادّتين توجد ذرّات هيدروجين، H ، “مكشوفة من الإلكترونات”.
- بين جزيئات اليوريا وكذلك بين جزيئات الأستون تتكوّن تأثيرات متبادلة من نوع ڤان در ڤالس فقط.
- جزيئات اليوريا وكذلك جزيئات الأستون يمكنها أن تُكوِّن أربطة هيدروجينيّة مع جزيئات الماء.
הסבר
למולקולות של אוריאה יש אטומי מימן חשופים מאלקטרונים ולמולקולות של האצטון יש אטום חמצן שמהווה מוקד ליצירת קשרי מימן. - حضّروا في المختبر 0.5 لتر محلول، بواسطة إذابة 6.05 غرام نترات الحديد، Fe(NO3)3(s)، في الماء.
الكتلة المولاريّة لِ Fe(NO3)3(s) هي .
ما هو التركيز المولاريّ لأيونات NO‾3(aq) في هذا المحلول؟- 0.025M
- 0.05M
- 0.075M
- 0.15M
הסבר
NO‾3(aq) Fe(NO3)3(s) 3 : 1 יחס מולים 6.05 m (גרם) 242 Mw (גרם למול) 0.075 0.025 n (מול) 0.05 V (ליטר) 0.15 C (מול לליטר) - حامض الماليك هو حامض يُكسِب الثمار طعمًا حامضًا بعض الشيء.
أمامك تمثيل مختصر للصيغة البنائيّة لجزيء حامض الماليك: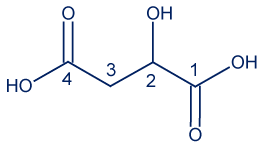 أمامك أربعة أقوال “أ-د” تتعلّق بدرجات تأكسد ذرّات الكربون في جزيء حامضالماليك. ما هو القول الصحيح؟
أمامك أربعة أقوال “أ-د” تتعلّق بدرجات تأكسد ذرّات الكربون في جزيء حامضالماليك. ما هو القول الصحيح؟- درجة تأكسد ذرّة الكربون 1 تختلف عن درجة تأكسد ذرّة الكربون 4.
- درجة تأكسد ذرّة الكربون 2 تساوي درجة تأكسد ذرّة الكربون 3.
- درجة تأكسد ذرّة الكربون 3 هي 2-.
- درجة تأكسد ذرّة الكربون 4 هي 2-.
הסבר
בציור מטה רשומות דרגות החמצון:
- الجدول الذي أمامك يعرض معطيات عن أربعة محاليل مائيّة I-IV:
المحلول حجم المحلول
(ملل)تركيز المحلول
(M)I HNO3(aq) 200 0.3 II NaOH(aq) 300 0.2 III CH3OH(aq) 200 0.3 IV Ba(OH)2(aq) 150 0.2 أمامك أربعة تحديدات “أ-د”. ما هو التحديد الصحيح؟
- pH المحلول II يساوي pH של المحلول IV.
- pH المحلول II أعلى من pH المحلول III.
- عندما نُضيف ماءً إلى المحلول I، ينخفض pH المحلول.
- عندما نُضيف ماءً إلى المحلول IV، يرتفع pH المحلول.
הסבר
תמיסה II היא תמיסה בסיסית בעלת pH>7.
תמיסה III היא ניטראלית pH=7.
- حامض الرومينيك (rumenic acid) هو حامض دهنيّ موجود في حليب الأبقار وفي منتَجاته.
أمامك تمثيل مختصر للصيغة البنائيّة لجزيء حامض الرومينيك: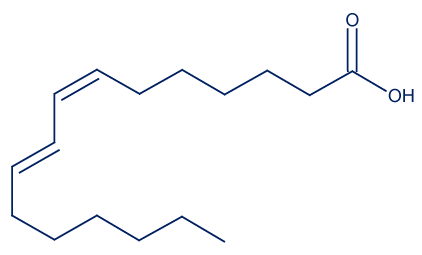 أمامك أربع جمل “أ-د”. ما هي الجملة الصحيحة؟
أمامك أربع جمل “أ-د”. ما هي الجملة الصحيحة؟- الصيغة الجزيئيّة لحامض الرومينيك هي: C17H32O2.
- الكتابة المختصرة لحامض الرومينيك هي: C18:2ω7cis,cis.
- أحد الأربطة المزدوجة في جزيء حامض الرومينيك هو بمبنى ترانس.
- حامض الرومينيك يتبع لمجموعة الأحماضالدهنيّة أوميچا 6.
הסבר
- معطى التفاعلان (1) وَ (2):
(1) H2(g) + I2(g) → 2HI(g) ΔHº1=-11kJ
(2) H2(g) + Cℓ2(g) → 2HCℓ(g) ΔHº2=?
الجدول الذي أمامك يعرضقيَم إنتالبيا الرباط.
الرباط I–I H–I Cℓ–Cℓ H–Cℓ إنتالبيا الرباط
151 299 242 431 ما هي قيمة ؟
- 184kJ-
- 184kJ+
- 52kJ-
- 52kJ+
הסבר
H2(g) + I2(g) → 2HI(g) ΔHº1=-11kJ2HI(g) → I2(g) + H2(g) 2H–I I–I H–H ΔHº= ΔHº(H–H) + ΔHº(I–I) + 2ΔHº(H–I)
-11 = ΔHº(H–H) + 151 – 2×299
ΔHº(H–H) = 436kJ(2) H2(g) + Cℓ2(g) → 2HCℓ(g) ΔHº2=?
2HCℓ(g) → Cℓ2(g) + H2(g) 2H–Cℓ Cℓ–Cℓ H–H ΔHº= ΔHº(H–H) + ΔHº(Cℓ–Cℓ) + 2ΔHº(H–Cℓ)
ΔHº(H–H) = 436 + 242 – 431.2 = -184kJ
تحليل قطعة من مقال علميّ – إلزاميّ
- اقرأ القطعة التي أمامك، وأجب عن جميع البنود “أ – ه” التي تليها (سؤال إلزاميّ – 20 درجة).
الليثيوم: حلّ لإنتاج جديد للأمونيا
الأمونيا، NH3(g)، هي مادّة حيويّة لإنتاج الأسمدة اللازمة للزراعة الحديثة. يُنتِجون الأمونيا في الوقت الحاضر في الصناعة في تفاعل بين غاز النيتروجين، N2(g), ، الذي في الهواء وبين غاز الهيدروجين، H2(g)، في شروط عالية للضغط ولدرجة الحرارة.
لإنتاج غاز الهيدروجين هناك حاجة لطاقة كبيرة. يحصلون على هذه الطاقة عادةً من عمليّات حرق وقود هيدروكربونيّ، الذي يُعتبر مصدر طاقة فانيًا (متآكلاً). لعمليّات الحرق تأثير سلبيّ على البيئة، لأنّه ينطلق في هذه العمليّات ثاني أكسيد الكربون، CO2(g)، إلى الغلاف الجوّيّ.
لهذا السببيحاول العلماء تطوير عمليّاتبديلة لإنتاج الأمونيا، تُستغَلّ فيها مصادر طاقة متجدّدة (مثل الطاقة الشمسيّة) بدون الإضرار بالبيئة، أي عمليّات مستدامة.
قام علماء من جامعة ستانفورد بتطوير عمليّة دائريّة في المختبر لإنتاج أمونيا في ضغط أتموسفيريّ (جوّيّ). استعملوا
في هذه العمليّة فلزّ (معدن) الليثيوم،Li(s).
مراحل العمليّة معروضة بشكل تخطيطيّ في التخطيط الذي أمامك:

العمليّات التي تحدث في كلّ واحدة من المراحل الثلاث مفصَّلة في الصفحة التالية.
في المرحلة I، يستعملون الطاقة الكهربائيّة، التي يحصلون عليها من مصادر طاقة متجدّدة، لإنتاج الفلزّ Li(s): يصهرون هيدروكسيد الليثيوم، LiOH(s)، ويمرّرون عبره تيّارًا كهربائيًّا. يَنتُج 1 مول من فلزّ الليثيوم، Li(s) من 1 مول LiOH(s).
في المرحلة II، يتفاعل Li(s) مع غاز النيتروجين، N2(g). يَنتُج نتريد الليثيوم، Li3N(s)، حسب التفاعل:
3Li(s) + 1⁄2 N2(g) → Li3N(s)
في المرحلة III، يتفاعل Li3N(s) مع الماء، H2O(ℓ). يَنتُج غاز الأمونيا، NH3(g) وَ LiOH(s)، حسب التفاعل:
Li3N(s) + 3H2O(ℓ) → 3LiOH(s) + NH3(g)
هيدروكسيد الليثيوم الذي نتج في المرحلة III يُعاد إلى بداية العمليّة، أي إلى المرحلة I، لإجراء عمليّة إضافيّة، وهكذا دواليك.
يؤكّد العلماء أنّ الليثيوم حيويّ لهذه العمليّة، لأنّ الليثيوم فقط يتفاعل مع N2(g) في درجة حرارة الغرفة.
العمليّة التي تمّ تطويرها في المختبر لم تُطبَّق حتّى الآن في الصناعة، إ لا لّا لّاأّنّ إمكانيّة إنتاج الأمونيا بطريقة يستعملون فيها مصادر طاقة متجدّدة هي إمكانيّة شيّقة للغاية، ويمكنها أن تُعجِّل تطويرًا صناعيًّا حديثًا.
Jeskins A, “Lithium could hold key to sustainable ammonia synthesis”, Chemistry World :المصدر
- صناعة إنتاج الأمونيا مسؤولة عن %3 بالتقريب من مجمل انطلاق غاز CO2(g) في العالم.
اشرح حسب القطعة، لماذا ينطلق CO2(g) في عمليّة إنتاج الأمونيا.
בתהליכי שריפת פחמימנים שבהם משתמשים להפקת גז מימן הנדרש להפקת אמוניה נפלט גז CO2(g). - صف فرقين في المستوى الميكروسكوبيّ بين Li(s) وَ Li3N(s).
Li(s) Li3N(s) מורכב מקטיונים וים אלקטרונים מורכב מקטיונים ואניונים קשר מתכתי קשר יוני יש אלקטרונים ניידים אין אלקטרונים ניידים - ג
- في المرحلة I من العمليّة الموصوفة في القطعة، يَصهرون LiOH(s). اكتب معادلة عمليّة انصهار LiOH(s).
LiOH(s) → Li+(ℓ) + OH‾(ℓ)
- حدِّد ما هو نوع التفاعل الذي يحدث في المرحلة II – حامض- قاعدة، أم أكسدة – اختزال، أم ترسيب. علّل تحديدك.
התגובה המתרחשת בשלב II היא תגובת חמצון חיזור.
יש בתגובה מעברי אלקטרונים Li(s) מוסר אלקטרונים ו- N2(g) מקבל אלקטרונים. - حدِّد إذا كان الماء في المرحلة III: مُذيبًا أم مختزِلاً أم حامضًا أم قاعدةً. علّل تحديدك.
המים הם חומצה כי הם מוסרים פרוטון.
- في المرحلة I من العمليّة الموصوفة في القطعة، يَصهرون LiOH(s). اكتب معادلة عمليّة انصهار LiOH(s).
- حسب التفاعلات التي في المراحل الثلاث للعمليّة الموصوفة في القطعة، يمكن الحصول من 3 مول LiOH(s) على 1 مول NH3(g). لكن عمليًّا، بهذه الطريقة، يمكن إنتاج أكثر من 1 مول NH3(g) من 3 مول LiOH(s). فسّر لماذا.
אפשר להפיק יותר מ- 1 מול NH3(g) מ- 3 מול LiOH(s) כי בשלב III החומר LiOH(s) נוצר מחדש ולכן ניתן להשתמש בו שוב בשלב I. - بهدف ملاءَمة العمليّة التي تمّ تطويرها في المختبر لعمليّة صناعيّة لإنتاج الأمونيا، هناك حاجة لموارد كثيرة.
اكتب حجاجًا )ادّعاءً معلَّلاً( واحدًا يؤيّد جدارة إنتاج الأمونيا بالطريقة الجديدة المعروضة في القطعة. علّل.
אפשרות 1:
מקור האנרגיה לתהליך הוא שמש, אנרגיה רבה, חסכון בכסף.
אפשרות 2:
עובדים בלחץ נמוך יותר, גם חסכון בכסף.
الفصل الثاني (60 درجة)
أجب عن ثلاثة من الأسئلة 10 – 14 (لكلّ سؤال – 20 درجة).
10. المبنى والترابط وكيمياء الغذاء
زيت جوز الهند هو زيت نباتيّ يُنتَج من ثمرة شجرة جوز الهند.
- معظم الزيوت النباتيّة (مثل زيت الزيتون، زيت الذُّرَة) هي سوائل في درجة حرارة الغرفة، بينما زيت جوز الهند هو صلب في درجة حرارة الغرفة.
القولان b ، a اللذان أمامك يتعلّقان بعوامل يمكنها أن تؤثّر على حالة المادّة (الحالة التراكميّة للمادّة) لزيت
جوز الهند في درجة حرارة الغرفة.
حدِّد أيّ قول، a أم b، هو الصحيح. فسّر لماذا دحضتَ القول الآخر.- في التريچليسيريدات التي في زيت جوز الهند توجد نسبة مئويّة عالية لأحماضدهنيّة مشبعة.
- في التريچليسيريدات التي في زيت جوز الهند توجد نسبة مئويّة عالية لأحماضدهنيّة غير مشبعة من نوع ترانس.
היגד a הוא ההיגד הנכון כי אחוז גבוה של חומצות שומן רוויות מאפשר יצירת אריזה צפופה ואינטראקציות ואן-דר-ולס חזקות בין המולקולות ולכן טמפרטורת היתוך גבוהה.
היגד b לא נכון כי בחומצת שומן צמחית(חומצת שומן טיבעית) אין חומצת שומן טרנס, קשרים כפולים גורמים לירידת טמפרטורת היתוך.
חומצות שומן מסוג טראנס נוצרות בעיקר בתהליכי הידרוגנציה של שמנים שמקורם בצמחים וכמעט אינן קיימות באופן טבעי. - زيت جوز الهند الذي مرّ بهدرجة (הידרוגנציה) يُستعمَل بديلاً للدهن في صناعة الغذاء.
- ما هي عمليّة الهدرجة؟
תהליך הידרוגנציה הוא סיפוח מולקולות מימן לקשר כפול (שבירת קשרים כפולים בין אטומי פחמן ע”י הוספת מימן). - حدِّد إذا كانت درجة حرارة انصهار زيت جوز الهند الذي مرّ بهدرجة أعلى من درجة حرارة انصهار زيت جوز الهند الطبيعيّ (الذي لم يمرّ بهدرجة) أم أقلّ منها. علّل تحديدك.
טמפרטורת ההיתוך גבוהה יותר לאחר תהליך ההידרוגנציה, כי מתקבלת חומצת שומן רוויה יותר(צפופה יותר). אינטראקציות ון-דר-ולס בין המולקולות חזקות יותר ונדרשת אנרגיה רבה יותלר לניתוק אינטראציות ון-דר-ואלס ולכן טמפרטורת הרתיחה גבוהה יותר.
- ما هي عمليّة الهدرجة؟
- تريليورين هو تريچليسيريد موجود في زيت جوز الهند.
أمامك تمثيل مختصر للصيغة البنائيّة للتريليورين: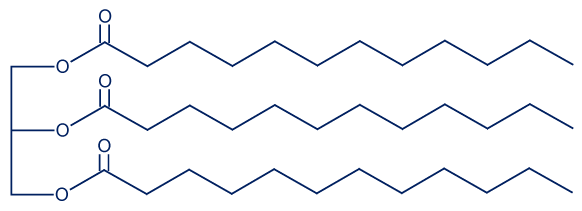 في حلمأة التريليورين يحصلون على حامضاللاوريك (lauric acid) وناتج إضافيّ.
في حلمأة التريليورين يحصلون على حامضاللاوريك (lauric acid) وناتج إضافيّ.- اكتب كتابة مختصرة لحامضاللاوريك.
C12:0 - اكتب تمثيلاً كاملاً للصيغة البنائيّة للناتج الإضافيّ الذي يَنتُج في تفاعل حلمأة التريليورين.
התוצר הנוסף שמתקבל הוא גליצרול.
נוסחת מבנה גליצרול: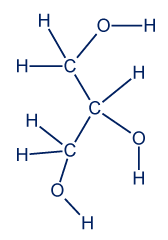
- اكتب كتابة مختصرة لحامضاللاوريك.
- ذائبيّة حامضاللاوريك في الماء منخفضة. فسّر لماذا.
בין מולקולות החומצה הלאורית ישנם אינטראקציות ון-דר-ולס וקשרי מימן. החלק ההידרופובי של המולקולה גדול ולכן אינטראקציות ון-דר-ולס בין מולקולות החומצה הלאורית חזקות. לא מתאפשרת יצירת קשרי מימן בין מולקולות החומצה הלאורית למים (או נוצרים מעט מאד קשרי מימן בין מולקולות המים למולקולות החומצה הלאורית). - يُستعمَل حامضاللاوريك أيضًا لإنتاج الصابون لاورات الصوديوم، CH3(CH2)10COONa(s).
- يَنتُج لاورات الصوديوم في تفاعل حامضاللاوريك مع مادّة إضافيّة.
حدِّد أيّة مادّة – NaOH(aq) أم NaCℓ(aq) – تلائم التفاعل مع حامضاللاوريك لإنتاج الصابون. علّل تحديدك.
החומר שנוצר הוא NaOH(aq). התגובה היא תגובת חומצה בסיס. - توجد بين جسيمات لاورات الصوديوم أربطة أيونيّة وكذلك تأثيرات متبادلة من نوع ڤان در ڤالس.
فسّر هذا التحديد.
חלק הידרופובי גדול, בין החלקים ההידרופוביים ( הפחמימניים) ישנם אינטראקציות ואן דר ואלס, וחלק יוני בין יוני הנתרן החיובי לבין הקצה הקרבוקסילי שללא המימן הוא טעון שלילי.
- يَنتُج لاورات الصوديوم في تفاعل حامضاللاوريك مع مادّة إضافيّة.
11. סטוכיומטריה ומצב גז
השאלה עוסקת בגז דו-חנקן חמצני, N2O(g), המכונה “גז צחוק”.
- בכלי סגור A שנפחו 1 ליטר יש 4.4 גרם N2O(g).
בכלי סגור B שנפחו 2 ליטר יש 6.4 גרם חמצן O2(g).
שני הכלים מוחזקים בטמפרטורה זהה.
לפניך שני היגדים I ו- II.
קבע איזה מן ההיגדים I או II הוא ההיגד הנכון. נמק את קביעתך.- לחץ הגז בכלי A גדול פי 2 מלחץ הגז בכלי B.
- לחץ הגז בכלי A שווה ללחץ הגז בכלי B.
כלי A כלי B חומר N2O(g) O2(g) m (גרם) 4.4 6.4 Mw (גרם למול) 44 32 n 0.1 0.2 V 1 2 היגד II נכון כי בכלי B מספר המולים של הגז כפול ממספר המולים בכלי A, אבל גם נפח הכלי הוא פי 2, ולכן היחס ליחידת נפח במספר החלקיקים הוא שווה. מספר ההתנגשויות בדפנות הכלי ליחידת זמן ושטח יהיה זהה.
- בטמפרטורות מעל 577°C, N2O(g) מתפרק ליסודותיו, חנקן וחמצן.
- נסח ואזן את תגובת הפירוק של N2O(g) ליסודותיו.
N2O(g) → N2(g) + ½O2(g)
- ביצעו ניסוי. לתוך כלי סגור המכיל אוויר הכניסו, N2O(g). חיממו את הכלי לטמפרטורה של 600°C, במשך t דקות, עד שלחץ הגזים לא השתנה יותר.
איזה מן הגרפים III-I שלפניך מתאר נכון את השינוי במספר המולים של O2(g) בתוך הכלי? נמק. גרף II
גרף II
באויר יש חמצן ועד לזמן t נוצר עוד חמצן, ולכן מספר המולים של החמצן גדל ומדקה t אין שינוי.
- נסח ואזן את תגובת הפירוק של N2O(g) ליסודותיו.
- משתמשים ב- N2O(g) בשילוב עם O2(g), בטיפולי שיניים (אצל ילדים במיוחד) כדי להפחית את תחושת הכאב ואת רמת החרדה.
המטופל שואף תערובת של שני הגזים מתוך מסכה המונחת על אפו.
ב- 100 מ”ל של תערובת הגזים התנאי החדר יש 30 מ”ל N2O(g) ו- 70 מ”ל O2(g).
בכל נשימה המטופל שואף 500 מ”ל מתערובת הגזים.
חשב את מספר המולקולות של N2O(g) שהמטופל שואף בכל נשימה.
פרט את חישוביך.
נתון:- הנפח של 1 מול גז בתנאי החדר הוא 25 ליטר.
- ב- 1 מול של חלקיקים יש 6.02×1023 חלקיקים.
אם ב- 100 מ”ל תערובת יש 30 מ”ל N2O(g) אז ב- 500 מ”ל תערובת יש 150 מ”ל N2O(g) שהם 0.15 ליטר.N = n × NA = 0.006 × 6.02×1023 = 3.612×1021
מספר המולקולות הוא 3.612×1021 מולקולות N2O(g).
- ד
- מאחסנים דו-חנקן חמצני בלחץ גבוה, במצב נוזל, במכלים מיוחדים.
מיכל המיועד לשימוש במרפאות השיניים מכיל 2.92 ק”ג של N2O(ℓ).
מה יהיה הנפח של מסה זו של N2O(g) אילו היו מאחסנים אותו בתנאי החדר?
פרט את חישוביך.V = n×Vm = 66.36×25 = 1659 Litter
נפח הגז יהיה 1659 ליטר.
נתון: הנפח של 1 מול גז בתנאי החדר הוא 25 ליטר. - בתעשייה מפיקים את הגז N2O(g) על-ידי חימום אמוניום חנקתי, NH4NO3(s), על פי התגובה:
NH4NO3(s) → N2O(g) + H2O(ℓ)
חשב את המסה של NH4NO3(s) הדרושה כדי להפיק 2.92 ק”ג של דו-חנקן חמצני.
פרט את חישוביך.NH4NO3(s) N2O(g) 1 : 1 יחס מולים 66.36 66.36 n (מול) 80 Mw (גרם למול) 5308.8 m (גרם) דרושים 5308.8 גרם NH4NO3(s).
- מאחסנים דו-חנקן חמצני בלחץ גבוה, במצב נוזל, במכלים מיוחדים.
12. חמצון חיזור וסטוכיומטריה
השאלה עוסקת ביסוד כלור, Cℓ2(g), ובכמה מתרוכובותיו.
- הכלור הוא אחד המגיבים בכל אחת מן התגובות (1)-(3) שלפניך:
(1) Cℓ2(g) + 2Na(s) → 2NaCℓ(s)
(2) Cℓ2(g) + F2(g) → 2CℓF(g)
(3) Cℓ2(g) + 2H2O(ℓ) → 2HCℓO(aq) + H3O+(aq) + Cℓ‾(aq)
- עבור כל אחת מן התגובות (1) ו- (2), קבע אם Cℓ2(g) הוא המחמצן או המחזר. נמק.
 בתגובה (1) Cℓ2(g) הוא מחמצן, כי הוא יורד בדרגת החמצון מ- 0 ל- 1-, הוא מקבל אלקטרונים ועובר תגובת חיזור.
בתגובה (1) Cℓ2(g) הוא מחמצן, כי הוא יורד בדרגת החמצון מ- 0 ל- 1-, הוא מקבל אלקטרונים ועובר תגובת חיזור. בתגובה (1) Cℓ2(g) הוא מחזר, כי הוא עולה בדרגת החמצון מ- 0 ל- 1+, הוא מוסר אלקטרונים ועובר תגובת חמצון.
בתגובה (1) Cℓ2(g) הוא מחזר, כי הוא עולה בדרגת החמצון מ- 0 ל- 1+, הוא מוסר אלקטרונים ועובר תגובת חמצון. - בתגובה (3) יש אטומי כלור בשלושה סוגי חלקיקים.
קבע את דרגת החמצון של אטומי הכלור בכל אחד מן החלקיקים.
- עבור תגובה (3), קבע אם Cℓ2(g) מגיב רק כמחמצן, רק כמחזר או גם כמחמצן וגם כמחזר.
על פי קביעת דרגות החמצון בתגובה מספר (3) ניתן לקבוע כי ה- Cℓ2(g) מגיב גם כמחמצן וגם כמחזר.
ניתן לקבוע כי ה- Cℓ2(g) מגיב גם כמחמצן וגם כמחזר.
- עבור כל אחת מן התגובות (1) ו- (2), קבע אם Cℓ2(g) הוא המחמצן או המחזר. נמק.
- ב
- כאשר מזרימים גז כלור, Cℓ2(g), לכלי המכיל רדיד אלומיניום, Aℓ(s), מתרחשת תגובה.
נסח ואזן את התגובה בין Cℓ2(g) ובין Aℓ(s).2Aℓ(s) + 3Cℓ2(g) → 2AℓCℓ3(s)
- כמה מול אלקטרונים עברו בתגובה שבה הגיבו 4.05 גרם Aℓ(s) עם כמות מתאימה של Cℓ2(g)? פרט את חישוביך.

e‾ Aℓ 6 : 2 יחס מולים 4.05 m (גרם) 27 Mw (גרם למול) 0.45 0.15 n עברו 0.45 מול אלקטרונים.
- כאשר מזרימים גז כלור, Cℓ2(g), לכלי המכיל רדיד אלומיניום, Aℓ(s), מתרחשת תגובה.
יש תרכובות המכילות יונים רב-אטומיים של כלור, כגון: יוני על-כלורט CℓO‾4, יוני כלורט CℓO‾3, יוני תת-כלוריט, CℓO‾.
סעיפים ג,ד,ה עוסקים בשימושים של אחדות מתרכובות אלה.
- תערובת של אמוניום על-כלורט, NH4CℓO4(s), ו- Aℓ(s), משמשת דלק מוצק להנעת טילים הנושאים חלליות. חומרים אלה יכולים להגיב על פי תגובה (4) שלפניך.
(4) 3NH4CℓO4(s) + 3Aℓ(s) → Aℓ2O3(s) + AℓCℓ3(s) + 6H2O(g) + 3NO(g)
במתקן ניסוי הגיבה דגימה של 0.6 מול NH4CℓO4(s) עם כמות מתאימה של Aℓ(s) על פי תגובה (4).
חשב את הנפח הכולל של הגזים שהתקבל בתגובה זו. פרט את חישוביך.
נתון: בתנאי הניסוי הנפח של 1 מול גז הוא 35 ליטר.NO(g) H2O(g) NH4CℓO4(s) 3 : 6 : 3 יחס מולים 0.6 1.2 0.6 n (מול) כולל n = 1.8moℓ
V=n×Vm=1.8×35=63הנפח הכולל הוא 63 ליטר.
- אשלגן כלורט, KCℓO3(g), משמש בין השאר כמקור ל- O2(g) במעבדות.
בתנאים מתאימים, KCℓO3(g) מתפרק ל- O2(g) ולתוצר נוסף.
קבע מהי הנוסחה של התוצר הנוסף – KCℓ או KCℓO4. נמק את קביעתך. ניתן לראות שהחמצן (O) עובר תגובת חמצון, עולה בדרגת החמצון, ולכן יש צורך לחפש תוצר שעבר תהליך חיזור.
ניתן לראות שהחמצן (O) עובר תגובת חמצון, עולה בדרגת החמצון, ולכן יש צורך לחפש תוצר שעבר תהליך חיזור.
נבדוק את דרגת החמצון בחומרים הנתונים: התוצר הוא KCℓ כי אטומי הכלור עוברים תגובת חיזור, ירדו בדרגת החמצוחן מ- 5+ ל- 1-.
התוצר הוא KCℓ כי אטומי הכלור עוברים תגובת חיזור, ירדו בדרגת החמצוחן מ- 5+ ל- 1-. - תמיסת נתרן תת כלוריט, NaCℓO(aq), המכונה “אקונומיקה”, משמשת לחיטוי ולניקוי.
ב- 100 מ”ל תמיסת אקונומיקה מומסים 3 גרם NaCℓO(s).
חשב את הריכוז המולרי של יוני CℓO‾(aq) בתמיסה זו. פרט את חישוביך.CℓO‾(aq) NaCℓO(s) 1 : 1 יחס מולים 3 m (גרם) 74.5 Mw (גרם למול) 0.0412 0.0412 n (מול) 0.1 V (ליטר) 0.402 C (מול לליטר)
13. חומצות ובסיסים וסטוכיומטריה
חומצה גופרתית, H2SO4(ℓ), היא חומר גלם חשוב בתעשייה הכימית.
כאשר מערבבים תמיסת H2SO4(aq) עם תמיסת סידן הידרוקסיד, Ca(OH)2(aq), שוקע מוצק לבן. המוצק הוא סידן גופרתי, Ca2SO4(s) (“גבס”).
לפניך ניסוח התגובה:
Ca2+(aq) + 2OH‾(aq) + 2H3O+(aq) + SO2-4(aq) → CaSO4(s) + 4H2O(ℓ)
תלמידים ערכו ניסוי, לכלי שהכיל 20 מ”ל תמיסת H2SO4(aq) בריכוז 0.25M הוסיפו בהדרגה 100 מ”ל תמיסת Ca(OH)2(aq) ומדדו את המוליכות החשמלית של התמיסה.
הגרף שלפניך מציג באופן סכמטי את השינוי במוליכות החשמלית של התמיסה במהלך הניסוי.
- א
- הסבר מדוע בנקודה B המוליכות של התמיסה זניחה.
לא נותרו בתמיסה יונים ניידים. כל היונים שהיו בתמיסה הגיבו ויצרו מים ואת המוצק CaSO4(s). - חשב את הריכוז של תמיסת Ca(OH)2(aq) שבה השתמשו בניסוי. פרט את חישוביך.
H3O+(aq) H2SO4(aq) 2 : 1 יחס מולים 0.02 V (ליטר) 0.25 C (מול לליטר) 0.01 0.005 n (מול) OH‾(aq) H3O+(aq) 1 : 1 יחס מולים 0.01 0.01 n (מול) Ca(OH)2(aq) OH‾(aq) 1 : 2 יחס מולים 0.005 0.01 n (מול) 0.05 V (ליטר) 0.1 C (מול לליטר) הריכוז של תמיסת Ca(OH)2(aq) הוא 0.1M.
- הסבר מדוע בנקודה B המוליכות של התמיסה זניחה.
- במהלך הניסוי מדדו התלמידים גם את ה- pH של התמיסה.
- נמצא כי ה- pH של התמיסה בנקודה A שבגרף הנתון נמוך מן ה- pH של התמיסה בנקודה B. הסבר ממצא זה.
בנקודה A היו בתמיסה עודף יוני H3O+(aq). נקודה B היא נקודת הסתירה, אין בתמיסה עודף יוני OH‾(aq) או עודף יוני H3O+(aq) ולכן ה- pH גבוה יותר (שווה ל-7). - נמצא כי ה- pH של התמיסה בנקודה C שבגרף הנתון גבוה מן ה- pH של התמיסה בנקודה B. הסבר ממצא זה.
בנקודה C יש בתמיסה עודף יוני OH‾(aq), כתוצאה מעודף בתמיסת Ca(OH)2(aq). ולכן ה- pH גבוה מ- 7 וגבוה מהערך בנקודה B.
- נמצא כי ה- pH של התמיסה בנקודה A שבגרף הנתון נמוך מן ה- pH של התמיסה בנקודה B. הסבר ממצא זה.
- בניסוי אחר ערבבו 200 מ”ל תמיסת H2SO4(aq) בריכוז 0.25M עם 300 מ”ל תמיסת אשלגן הידרוקסידי, KOH(aq), בריכוז 0.3M . בתגובה שהתרחשה התקבל נוזל צלול (לא נוצר משקע).
- רשום ניסוח נטו לתגובה שהתרחשה.
H3O+(aq) + OH‾(aq) → 2H2O(ℓ) - קבע אם בתום התגובה היה ה- pH של התמיסה חומצי, בסיסי או ניטרלי.
פרט את חישוביך.H3O+(aq) H2SO4(aq) 2 : 1 יחס מולים 0.2 V (ליטר) 0.25 C (מול לליטר) 0.1 0.05 n (מול) OH‾(aq) H3O+(aq) 1 : 1 יחס מולים 0.3 V (ליטר) 0.3 C (מול לליטר) 0.09 0.09 n (מול) OH‾(aq) H3O+(aq) 1 : 1 יחס מולים 0.09 0.1 n התחלה (מול) 0.09 0.09 n תגובה (מול) — 0.01 n סוף (מול) בתמיסה יש עודף יוני H3O+(aq) ולכן ה- pH של התמיסה חומצי.
- חשב את הריכוז המולרי של יוני K+(aq) בתמיסה הצלולה שהתקבלה.
K+(aq) KOH(aq) 1 : 1 יחס מולים 0.09 0.09 n (מול) 0.5 V (ליטר) 0.18 C (מול לליטר) ריכוז יוני K+(aq) הוא 0.18M.
- רשום ניסוח נטו לתגובה שהתרחשה.
14. אנרגייה וקצב תגובה
במשך שנים חקרו מדענים ותלמידי כימיה את בעירת הנר.
התרכובת העיקרית המרכיבה את שעוות הנר היא פחמימן שנוסחתו היא: C25H52.
נמצא כי בעת בעירה של פתיל הנר מתרחשים כמה תהליכים: השעווה ניתכת, נספגת בפתיל, נהפכת לגז ומגיבה בתגובת שריפה עם החמצן, O2(g), שבאוויר.
- נסח ואזן את תגובת השריפה המלאה של C25H52(g).
C25H52(g) + 38O2(g) → 25CO2(g) + 26H2O(g)
סעיפים ב ו-ג עוסקים בניסוי שערכו תלמידים במעבדב.
התלמידים שקלו נר שעווה, הדביקו אותו לצלוחית, הדליקו את פתיל הנר באמצעות גפרור דולק עד שנוצרה להבה קבועה בקצה הנר, ורשמו תצפית.
- ב
- מהי המערכת בניסוי המתואר?
C25H52(g) , O2(g) , CO2(g) , H2O(g) - קבע אם ההיגד שלפניך הוא נכון או לא נכון. נמק את קביעתך.
הבעירה של פתיל הנר מספקת אך ורק את אנרגיית השפעול הדרושה לתגובת השריפה של C25H52(g).
לא נכון. על פי מה שכתוב בתחילת השאלה שעוות הנר עוברת גם היתוך (ממוצק לנוזל) ואידוי (מנוזל לגז) וכן חלק מהאנרגיה משתחררת בצורת אור בצבע צהוב.
- מהי המערכת בניסוי המתואר?
- לאחר שהנר בער במשך 10 דקות, כיבו התלמידים את הנר ושקלו אותו.
נמצא שמסת הנר ירדה ב- 1 גרם.
על פי חישוב נמצא שכמות האנרגייה שנפלטה בתגובת השריפה של 1 גרם C25H52(g) שווה ל- 34kJ.
חשב את שינוי האנתלפיה התקנית, ΔHº, בתגובת השריפה של 1 מול C25H52(g). פרט את חישוביך.אנרגיה
(kJ)C25H52(g)
(מול)34 0.002841 11967 1 משתחררים 11967kJ.
- ד
- אנתלפיית האידוי של הפחמימן C25H52(ℓ) היא
.
חשב את ערכו של ΔHº בעבור תגובת השריפה המלאה של 1 מול C25H52(ℓ).
פרט את חישוביך.C25H52(ℓ) →
C25H52(g)ΔH=126kJC25H52(g)+ 38O2(g) → 25CO2(g) + 26H2O(g) ΔH=-11967kJC25H52(ℓ) + 38O2(g) → 25CO2(g) + 26H2O(g) ΔH=-11841kJ
- לפניך דיאגרמת אנרגיה
 העתק את הדיאגרמה למחברתך ומקם בה את המגיבים ואת התוצרים של שתי תגובות שריפה:
העתק את הדיאגרמה למחברתך ומקם בה את המגיבים ואת התוצרים של שתי תגובות שריפה:
תגובת השריפה המלאה של C25H52(g) ותגובת השריפה המלאה של C25H52(ℓ).
סמן בדיאגרמה שבמחברתך את ערכי ΔHº המתאימים.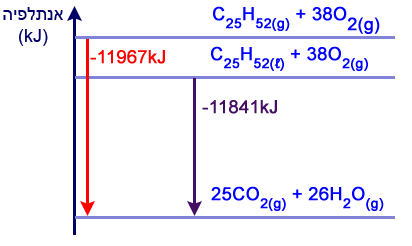
- אנתלפיית האידוי של הפחמימן C25H52(ℓ) היא
|  |