מצבי צבירה
לחומר שלושה מצבי צבירה בסיסיים : מוצק, נוזל וגז. בתוכנית הלימודים נעסוק במצבי צבירה אלו.
למרות זאת, יש לציין כי כיום מוכרים למדע מצבי צבירה נוספים כמו מצב הפלסמה. ישנן גם פאזות (מצבים) נוספות כמו תמיסות מסוגים שונים.
ההגדרה של מצבי הצבירה הבסיסיים מוצק נוזל וגז, איננה מוחלטת. ישנם חומרים שונים ששייכים להגדרה בסיסית זו וישנם כאלו שאינם שייכים אליה.
דוגמה. זכוכית, הנראית מוצק. בדיקה מדעית שלה מראה שהיא אינה תואמת באופן מוחלט את ההגדרה לחומר מוצק (בפרקים מתקדמים, נסביר מדוע).
בפרק זה נתייחס למוצק הגבישי.
כאמור, לחומר שלושה מצבי צבירה בסיסיים: מוצק, נוזל וגז.
נסכם את המאפיינים של מצבי הצבירה השונים:
| מאפיין / מצב צבירה | מוצק | נוזל | גז |
| תנועה נראית לעין ברמה המאקרוסקופית | אין | יש | יש (אם הגז צבעוני) |
| צפיפות החלקיקים | גבוהה | בינונית | נמוכה |
| סדר ומחזוריות | גבוהים | בינוניים | אין |
| תנועה מיקרוסקופית | תנודתיות | תנודתיות וסיבוב | תנודתיות, סיבוב ומעתק |
| כוחות בין חלקיקים | חזקים | חלשים | אין (גז אידיאלי) |
| אנרגיה (של אותו חומר) | נמוכה | בינונית | גבוהה |
במוצק הגבישי חלקיקים שמסודרים במבנה בעל סדר ומחזוריות גבוהים; חלקיקי החומר צפופים וישנה משיכה ביניהם; החלקיקים נעים בתנועה שאינה מורגשת ואינה נראית לעין הנקראת תנועה תנודתית (ויברציה). זו מעין תנועת רעידה.
במצב נוזל המרחק בין חלקיקי החומר גדול יותר בהשוואה למוצק; המשיכה בין חלקיקי החומר חלשה יותר ומתאפשרת תנועה רבה יותר של החלקיקים. חלקיקי החומר “מתחככים” זה בזה ונעים בתנועה סיבובית בנוסף לתנועה התנודתית. החומר מקבל את צורת הכלי שבו הוא נמצא ואינו מסודר כמו המוצק באופן מחזורי.
במצב גז המשיכה בין חלקיקי החומר אינה מורגשת; צפיפות החומר נמוכה מאוד ובנוסף לתנועת התנודה והסיבוב, המולקולות נעות באופן חופשי בחלל שבו הן נמצאות. לתנועה זו קוראים מעתק.
ניתן לעבור ממצב צבירה אחד לשני על-ידי הוספת אנרגיה מהסביבה לחומר או על-ידי שחרור אנרגיה מהחומר לסביבה הקרובה אליו.
כשעוברים ממצב צבירה מוצק למצב צבירה נוזל או ממצב צבירה נוזל למצב צבירה גז יש להשקיע אנרגיה. האנרגיה נדרשת לפירוק הקשרים בין חלקיקי החומר.
כשעוברים ממצב צבירה גז למצב צבירה נוזל או ממצב צבירה נוזל למצב צבירה מוצק נפלטת אנרגיה כי נוצרים קשרים בין חלקיקי החומר.
לכל אחד ממעברי מצב הצבירה ישנם שם וטמפרטורה המאפיינת אותו.
תהליך היתוך (או התכה) הוא שינוי מצב צבירה ממוצק לנוזל.
כך ינוסח תהליך המתאר שינוי מצב צבירה של חומר A ממצב מוצק ולמצב נוזל:
A(s) → A(ℓ)
תהליך היתוך מאופיין בטמפרטורת היתוך. לכל חומר טמפרטורת היתוך אופיינית לו בלחץ אטמוספרי. טמפרטורה זו תלויה בחוזק הקשרים בין חלקיקי החומר.
תהליך רתיחה שינוי מצב צבירה ממצב נוזל למצב גז.
כך ינוסח תהליך המתאר שינוי מצב צבירה של חומר A ממצב נוזל למצב גז:
A(ℓ) → A(g)
תהליך רתיחה מאופיין בטמפרטורת רתיחה. לכל חומר טמפרטורת רתיחה אופיינית לו בלחץ אטמוספרי. טמפרטורה זו תלויה בחוזק הקשרים בין חלקיקי החומר.
טמפרטורת היתוך – Tm.
טמפרטורת רתיחה – Tb.
כאמור, יכולים להתרחש גם תהליכים הפוכים לתהליכים שתיארנו.
תהליך עיבוי שבו גז הופך לנוזל
A(g) → A(ℓ)
תהליך עיבוי מתרחש באותה הטמפרטורה שבה מתרחש תהליך רתיחה.
תהליך קיפאון (התמצקות)
A(ℓ) → A(s)
תהליך זה מתרחש באותה הטמפרטורה שבה מתרחש תהליך היתוך.
אם היינו מצליחים לשמור על טמפרטורה קבועה של 0°C בכלי עם מי קרח (שהם גם מים וגם קרח), מצב המים הנוזליים והקרח (מים במצב מוצק) היה נשמר כל עוד הטמפרטורה הייתה נשמרת. אם היינו מקררים את מי הקרח, המים היו קופאים. אם היינו מחממים את מי הקרח, הקרח היה ניתך והופך לנוזל.
ישנם חומרים שעוברים שינוי ממצב צבירה מוצק לגז ולהיפך באופן ישיר. תהליך זה נקרא המראה ומתואר באופן הבא :
A(s) → A(g)
דוגמאות לחומרים העוברים המראה הן היוד והפחמן הדו-חמצני המוצק, הידוע בכינויו “קרח יבש”.
בעזרת נתוני טמפרטורת ההיתוך וטמפרטורת הרתיחה של החומר ניתן לקבוע מה יהיה מצב הצבירה שלו בטמפרטורות שונות.
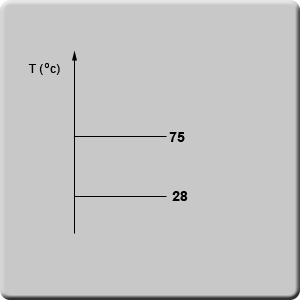
למשל, אם נתון חומר X שידוע שיש לו טמפרטורת היתוך (Tm) של 28°C וטמפרטורת רתיחה של 75°C, נוכל לקבוע מה יהיה מצב הצבירה שלו בטמפרטורה של 32°C.
איך נוכל לקבוע את מצב הצבירה של חומר X בטמפרטורה של 32°C בעזרת המידע הידוע עליו ?
נשרטט תרשים ובו ציר הטמפרטורה. נציין תחילה את טמפרטורת ההיתוך והרתיחה של החומר.
לתרשים נוסיף את הטמפרטורה שבה רוצים לבדוק את מצב הצבירה של החומר (הקו האדום).
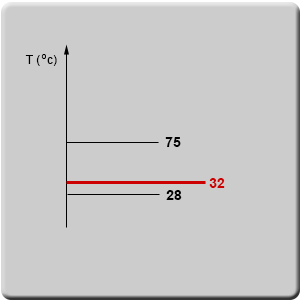
מצב הצבירה של חומר X בטמפרטורה של 32°C הוא נוזל כי טמפרטורת הבדיקה היא מעל לטמפרטורת ההיתוך אבל מתחת לטמפרטורת הרתיחה.
נתאר את שינויי הטמפרטורה שחלים בחומר כלשהו במצב צבירה מוצק בעת הוספת אנרגיה (חימום) בגרף הבא:
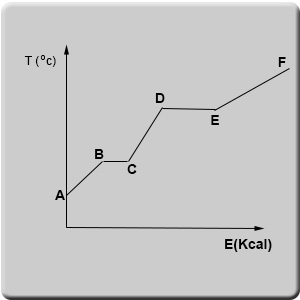
בגרף ניתן לראות שישנם קטעים שבהם תוספת אנרגיה (בצורת חום) לחומר מעלה את הטמפרטורה שלו (AB, CD, EF). לעומת זאת, בקטעים אחרים הוספת אנרגיה אינה גורמת לשינוי בטמפרטורת החומר (BC, DE).
כיצד ניתן להסביר את תוצאות המדידה (כלומר את הגרף המתקבל)?
ראשית, עלינו להכיר את המושגים הרמה המאקרוסקופית והרמה המיקרוסקופית.
הרמה המאקרוסקופית מתייחסת לדברים שאנו רואים, חשים, או מודדים. במקרה זה, אנו מודדים שינויי טמפרטורה כתוצאה מהוספת אנרגיה לחומר.
ואילו הרמה המיקרוסקופית מתייחסת לחלקיקי החומר ולמה שקורה בין חלקיקי החומר, (כלומר לקשרים בין חלקיקי החומר ולסוג הקשרים), לפני הוספת אנרגיה ובעקבות הוספת האנרגיה. את מה שמתרחש איננו רואים אבל יכולים להסביר. בהמשך נלמד שכשמתייחסים לרמה המיקרוסקופית של החומר יש להתייחס לסוג החלקיקים המרכיבים את החומר, לקשרים שביניהם ולסוגי התנועה שלהם. בשלב הזה, כיוון שלא למדנו על סוגי החלקיקים השונים המרכיבים את החומר ועל הקשרים שביניהם, לא נתייחס למושגים אלה אבל כן נתייחס לאופני התנועה שיש לחומר במצבי הצבירה השונים שלו ברמה המיקרוסקופית.
ובחזרה לגרף:
בנקודה A החומר הנתון היה במצב צבירה מוצק. התחלנו לחמם את החומר. הוספת אנרגיה מגבירה את מהירות התנועה הממוצעת של חלקיקי החומר. הביטוי החיצוני לעובדה שחלקיקי החומר נעים מהר יותר הוא עליית הטמפרטורה. היא ממשיכה לעלות עד לנקודה B בגרף.
מנקודה B ועד לנקודה C הוספת האנרגיה לא גורמת לעלייה בטמפרטורה. מה קורה לאותה האנרגיה? האם היא הולכת לאיבוד? במשך שנים רבות, כמות האנרגיה המשויכת לקטע BC נקראה חום כמוס. מדענים לא ידעו להסביר ולייחס את אותה האנרגיה לשינויים שחלו בחומר. כיום ידוע שהאנרגיה הנוספת לחומר בקטע BC גורמת לפירוק חלק מהקשרים בין חלקיקי החומר. כתוצאה מכך צפיפות החומר קטנה ומשתנה מצב הצבירה שלו. זה קורה לאורך כל הקטע BC. כל עוד כל החומר לא שינה את מצב הצבירה שלו אין שינוי בטמפרטורת החומר. רק כאשר כל החומר עבר את שינויי מצב הצבירה תחול עלייה בטמפרטורת החומר. משמעותה של עלייה זו היא ששוב חלה עלייה במהירות הממוצעת של חלקיקי החומר.
לאורך הקטע CD בגרף חלה עליה בטמפרטורה עד לנקודה D שבה שוב חל שינוי במצב הצבירה של החומר והוא הופך לגז. משם תוספת האנרגיה שוב מגדילה את המהירות הממוצעת של חלקיקי החומר וחלה עלייה בטמפרטורה שלו. בהמשך חלים עוד תהליכים נוספים שעליהם נדון בהמשך לימודי הכימיה.
מדידת טמפרטורה
את הטמפרטורה מודדים בעזרת מד טמפרטורה ולא במד חום כמו שכמעט כולנו נוהגים לומר.
ישנם מספר סולמות למדידת טמפרטורה. נציין שלושה אבל נעבוד בעיקר עם אחד מהם.
שלושת סולמות מדידת טמפרטורה המקובלים הם:
סולם צלזיוס (C)
סולם קלווין (K)
סולם פרנהייט (F)
הסולם של צלזיוס הוא סולם מדידת טמפרטורות, שבו הערך 0°C הוא הערך של טמפרטורת ההיתוך של מים והערך 100°C הוא טמפרטורת הרתיחה של מים. הסולם מחולק באופן שווה בין שתי נקודות אלה כאשר כל שנתה נקראת מעלה אחת.
סולם קלווין הוא סולם מדידה דומה לסולם צלזיוס, עם הזחה (הזזה) של נקודת האפס. בסולם המדידה הזה אין ערכים שליליים והערך הנמוך ביותר קרוי גם האפס המוחלט. זהו ערך הטמפרטורה שנחשב לערך הנמוך ביותר שניתן להגיע אליו באופן תאורטי ולא ניתן לחצות אותו.
הקשר בין הערך בסולם צלזיוס לערך בסולם קלווין מנוסח להלן:
°C = K-273.15
K = °C + 273.15
סולם המדידה השלישי הוא של פרנהייט. הסולם מבוסס על נקודת ההתכה של תערובת קרח ומלח וטמפרטורה ממוצעת של גוף אדם בריא. בלימודי הכימיה לא נעסוק בסולם זה. המעבר בין סולם צלזיוס לפרנהייט רשום להלן:
°C = [ 5(°F-32)] : 9