קשר קוולנטי
במילה קוולנטי שני חלקים:
- קו – (co) שיתוף
- וולנטי – (valent) ערכי
ביחד: שיתוף אלקטרונים ערכיים.
הקשר הקוולנטי נוצר בעיקר בין אטומים השייכים לקבוצת האל-מתכות בטבלה המחזורית.
נתבונן בטבלה המחזורית:

קבוצת האל-מתכות נמצאת מימין לקו האדום ואינה כוללת את הגזים האצילים (טור VIII). אטום המימן שייך גם הוא לקבוצת האל-מתכות.
ניזכר במה שכבר למדנו במיון חומרים: מרב היסודות ששייכים לקבוצה זו – המימן, החנקן, החמצן, הפלואור, הכלור, הברום והיוד – בנויים ממולקולות דו-אטומיות. עוד למדנו שהגופרית והזרחן הם יסודות שמופיעים בטבע כמולקולות רב-אטומיות. כל היסודות שהזכרנו בנויים מאטומי אל-מתכות היוצרים קשר קוולנטי זה עם זה. למעשה זהו קשר שבו כל אחד מהאטומים משתף אלקטרון/אלקטרונים ערכיים.
מושג נוסף משיעור היערכות אלקטרונים הוא אורביטל. זהו אזור מסביב לגרעין האטום שבו הסיכוי למצוא אלקטרון או אלקטרונים גדול. צורת האורביטל מתקבלת מפונקציה מתמטית מורכבת.
אז מה קורה בזמן יצירת קשר קוולנטי?
נזכיר שבכל אטום ישנם אלקטרונים. האלקטרונים נמצאים ברמות אנרגיה שונות באורביטלים שלהם. אורביטלים אלו נקראים אורביטלים אטומיים כי הם שייכים לאטום אחד בלבד.
כששני אטומים נקשרים ויוצרים קשר קוולנטי, נוצרת חפיפה בין האורביטלים האטומיים, בדרך-כלל החיצוניים ביותר, המכילים את אלקטרוני הערכיות. כתוצאה מהחפיפה נוצרים אורביטלים מולקולריים.
אורביטל מולקולרי מוגדר כאזור שבו נמצאים אלקטרונים משותפים לשני אטומים או יותר בקשר כימי. מכיוון שאנו דנים בקשר קוולנטי, אורביטל מולקולרי יהיה האזור שבו יש סיכוי למצוא את האלקטרונים המשותפים, השייכים לשני אטומים הקשורים בקשר קוולנטי. גם כאן יש מקרים מורכבים יותר שלא נדון בהם.
בעקבות השיתוף בין האטומים השונים, נוצרות מולקולות, הן של יסוד – המורכבות מסוג אחד של אטומים – הן של תרכובות – המורכבות מאטומים של יסודות שונים – שרמת האנרגיה האחרונה שלהם מלאה. מצב זה דומה לרמת האנרגיה האחרונה המואכלסת באלקטרונים של גז אציל הנמצא באותה שורה עם האטום של היסוד או בשורה מעליה, תלוי בסוג הקשר הכימי. באופן זה, מתקיימת יציבות כימית שבאה לידי ביטוי בשינויי אנרגיה שמלווים את יצירת הקשרים הכימיים. נדון בשינויים אנרגטיים אלו במועד מאוחר יותר.
בדוגמה הבאה ננסה להבין באופן מפורט יותר מה קורה בזמן יצירת קשר קוולנטי בין שני אטומי מימן. מה בעצם קורה כשאטום מימן פוגש אטום מימן נוסף?
לשם כך, ניזכר בהיערכות האלקטרונים של אטום המימן ובמבנה החלקיקי שלו.
לאטום המימן שלושה איזוטופים שלכולם אותה התנהגות כימית. נזכיר שמה שקובע את ההתנהגות הכימית הוא המבנה האלקטרוני ואלקטרוני הערכיות, ולא מספר הניוטרונים שבגרעין.
האיזוטופ הנפוץ ביותר הוא: הוא מורכב מאלקטרון אחד ופרוטון אחד. ההיערכות האלקטרונית שלו היא:
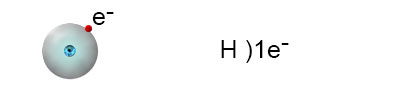
כדי להגיע למצב שבו רמת האנרגיה החיצונית מלאה, המימן צריך להוסיף אלקטרון אחד לרמה זו. יש לזכור, שלפי כלל האוקטט, ברוב המקרים, הרמה החיצונית של האטום תתמלא בעקבות יצירת קשר כימי בשמונה אלקטרונים. מכיוון שלמימן יש רק רמת אנרגיה אחת, היא יכולה להתמלא רק ב-2 אלקטרונים.
כששני אטומים מתקרבים זה לזה, נוצרת מערכת של דחיות ומשיכות של מטענים חשמליים בין החלקיקים (פרוטונים ואלקטרונים) של האטום האחד לחלקיקים של האטום השני. אלקטרון מאטום מימן אחד נמשך גם לגרעין שלו, אבל גם לגרעין של האטום השני, שכן, שניהם מכילים פרוטון חיובי. במקביל, נוצרת גם דחייה בין האלקטרונים של שני האטומים כי הם טעונים במטענים שליליים וגם בין הפרוטונים של שני האטומים כי הם טעונים במטענים חיוביים. דבר דומה קורה גם לאלקטרון של האטום השני. כלומר, ישנה מערכת של דחיות ומשיכות של מטענים חשמליים. ככל שהמרחק בין האטומים קטן, מערכת הדחיות והמשיכות מתגברת. להזכירכם, לפי חוק קולון ככל שמטענים חשמליים קרובים זה לזה, גם הדחייה (אם המטענים זהים) וגם המשיכה (אם המטענים שונים) מתגברות.
כעת ניגש לתוצאה הסופית. ידוע לנו שהמימן קיים בטבע כמולקולה דו-אטומית, כלומר כמולקולה שבה שני אטומי מימן קשורים זה לזה. ניתן לקבוע שסך כל המשיכות בין המטענים החשמליים גדול מסך כל הדחיות בין המטענים החשמליים ולכן נוצר הקשר הכימי בין שני אטומי מימן.
הקשר שנוצר בין שני האטומים הוא קשר קוולנטי. זהו קשר בין שני אטומים שבו כל אחד מהאטומים משתף אלקטרון אחד. עקב השיתוף, נוצר אורביטל מולקולרי אזור מרחבי חדש שבו נמצאים זוג האלקטרונים המשותפים לשני אטומי המימן. האלקטרונים המשותפים נמשכים על-ידי שני הגרעינים החיוביים של אטומי המימן.
האיור הבא מתאר באופן סכמטי ובשלושה שלבים את היווצרות הקשר הקוולנטי ויצירת האורביטל המשותף בין שני אטומי מימן:
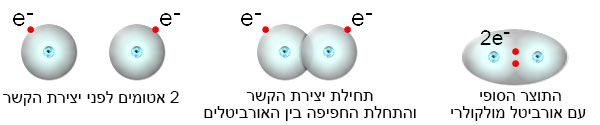
להלן הדמיה קצרה של תהליך יצירת הקשר הקוולנטי ויצירת האורביטל המשותף בין שני אטומי מימן
ניתן לתאר את הקשר בין אטומי המימן בכמה אופנים. לאורך הפרק נכיר כמה דרכים לתאר/לרשום/לייצג את התוצר שהתקבל בתהליך ועל כך בשיעורים הבאים.